Что такое бульон в микробиологии
Смотреть что такое "бульон питательный" в других словарях:
Бульон б питательный — Бульон, б. питательный * бульён, б. пажыўны * broth or nutrition b. жидкая питательная среда, используемая для культивирования клеток различных тканей и организмов. В Б. добавляют разные пищевые добавки при выращивании бактерий или др.… … Генетика. Энциклопедический словарь
БУЛЬОН — (от франц. слова bouillon навар), прежде обозначал исключительно навар из мяса на воде; в наст, время под Б. подразумевают всякого рода навар на воде. Различают Б.: 1) из мяса, 2) из рыбы, 3) из зелени и овощей и 4) специально лечебные. Для… … Большая медицинская энциклопедия
Питательный бульон — * пажыўны булён * nutrient broth or NB среда, богатая минеральными солями, витаминами, углеводными и др. полезными составляющими ее веществами, которая используется для выращивания микроорганизмов. Противоположность минимальная среда (см.),… … Генетика. Энциклопедический словарь
питательный — ая, ое; лен, льна, льно. 1. только полн. Содержащий в себе вещества, удовлетворяющие потребность в питании. П ые вещества. П ые соли. П ая среда (жидкие или твёрдые смеси веществ, на которых выращивают микроорганизмы в лабораторных или… … Энциклопедический словарь
питательный — ая, ое; лен, льна, льно. см. тж. питательность 1) только полн. Содержащий в себе вещества, удовлетворяющие потребность в питании. П ые вещества. П ые соли. П ая среда жидкие или твёрдые смеси веществ, на которых выращивают микроорганизмы в… … Словарь многих выражений
ПИТАТЕЛЬНЫЕ СРЕДЫ — ПИТАТЕЛЬНЫЕ СРЕДЫ, искусственные среды того или иного состава, предназначенные для культивирования микробов и простейших в лабораторных условиях. Впервые были введены для изолирования отдельных видов бактерий Р. Кохом в 1881 году, что создало… … Большая медицинская энциклопедия
малафья — абсолют, аврал, агапе, адья шакти, азбука, азот (солнечный), акт (половой), активизатор, алия, алкалоид, алкахест, алкоголь, аллилуйя, алхимия, амбра, амброзия, амвросия, аминь, амнезия, амок, амортизатор, амрита, анаболитик, ананда,… … Словарь синонимов
— Тип блюда: Категория: Рецепт приготовления … Энциклопедия кулинарных рецептов
ВСКАРМЛИВАНИЕ ДЕТЕЙ РАННЕГО ВОЗРАСТА — ВСКАРМЛИВАНИЕ ДЕТЕЙ РАННЕГО ВОЗРАСТА, особенно на первом году жизни, отличается целым рядом особенностей, соответствующих возрастным, функциональным и индивидуальным особенностям самого организма ребенка, условиям его жизни и окружающей среде.… … Большая медицинская энциклопедия
ГОСТ Р ИСО 11133-1-2008: Микробиология пищевых продуктов и кормов для животных. Руководящие указания по приготовлению и производству культуральных сред. Часть 1. Общие руководящие указания по обеспечению качества приготовления культуральных сред в лаборатории — Терминология ГОСТ Р ИСО 11133 1 2008: Микробиология пищевых продуктов и кормов для животных. Руководящие указания по приготовлению и производству культуральных сред. Часть 1. Общие руководящие указания по обеспечению качества приготовления… … Словарь-справочник терминов нормативно-технической документации
Естественные среды представляют собой природные субстраты (молоко, кровь, желчь, сыворотка, картофель). Искусственные содержат смесь природных органических веществ и продуктов их кислотного или ферментативного распада. Синтетические среды состоят из буферной солевой основы и растворов аминокислот, углеводов, пуринов, пиримидинов, нуклеотидов, нуклеозидов, жирных кислот, витаминов в точно установленных дозировках. В качестве источников азота в них используются аминокислоты. Достоинство этих сред в том, что они имеют постоянный состав, по ним можно определить потребности микробов в тех или иных питательных веществах.
Плотные питательные среды готовят из жидких с добавлением уплотнителя. В качестве уплотнителя обычно применяют агар-агар. Агар-агар – продукт, получаемый из морских водорослей, представляет собой желтоватый порошок или пластинки, содержит высокомолекулярные полисахариды, не расщепляется большинством микроорганизмов, не разрушается при автоклавировании, питательную ценность сред не изменяет, не подавляет рост микробов. Для иммунологических и бактериологических полей используется вымороженный, осветленный агар, который при кипячении или автоклавировании смеси порошка с водой расплавляется при температуре 85–100°С, а при охлаждении до 45–48°С образует гель.
Для приготовления, плотных питательных сред агар-агар добавляют в концентрации от 1,5 до 3%.
Простые среды.
Мясо-пептонный бульон (МПБ) является белковой основой всех сред.
Существует несколько способов приготовления МПБ:
а) на мясной воде с добавлением готового пептона – это так называемый мясо-пептонный бульон;
б) на переварах продуктов гидролиза исходного сырья при помощи ферментов (трипсина – бульон Хоттингера, пепсина – бульон Мартена).
Мясо-пептонный агар (МПА) – получают путей добавления к МПБ arap-arapa (1,5–3%). Если МПА распределен по диагонали пробирки или флакона – это скошенный агар. Для его получения пробирки для застывания среды оставляют в наклонном положении. Если среда распределена в пробирке вертикально высотой 5–7 см, это агар столбиком. МПА, застывший в чашках Петри в виде пластинки – пластинчатый агар. Если среда имеет вертикальный слой высотой 2–3 см, и диагональный слой такой же величины, это полускошенный агар.
Специальные питательные среды – среды, на которых создаются условия для выращивания тех бактерий, которые не растут на простых средах.
Кровяной агар или кровяной бульон – получают путем добавления к питательной среде 5–10% подогретой стерильной дефибринированной крови барана, кролика лошади, человека. Среда используется для выделения стрептококков, пневмококков и других бактерий, а также для изучения гемолитической активности.
Сывороточный бульон или сывороточный агар получают путем добавления к простым средам 15–20% лошадиной или бычьей сыворотки. Среда применяется для выделения пневмококков, менингококков.
Желчный бульон или желчный агар получают путем добавления к питательной среде медицинской желчи без консерванта, или свежеполученной от крупного рогатого скота. Среда применяется для выделения брюшнотифозных, паратифозных и дизентерийных палочек.
Специальные среды для культивирования анаэробных бактерий: среда Китта-Тароцци состоит из питательного бульона, глюкозы и кусочков печени или мясного фарша для адсорбции кислорода.
Желатин – животный белок, продукт частичного гидролиза коллагена. Имеет вид бесцветных или светло-желтых пластинок без запаха и вкуса. В холодной воде набухает, сильно поглощая воду. При температуре 30°С растворяется, при охлаждении до 20–22°С превращается в гель (студень). Используется в микробиологии для изучения протеолитических ферментов.
Дифференциально-диагностические среды позволяют различить один вид микроба от другого. Принцип построения дифференциально-диагностических сред основан на разной биохимической активности бактерий. В состав дифференциально-диагностических сред входит основная питательная среда, обеспечивающая размножение бактерий, определенный химический субстрат, различное отношение к которому является диагностическим признаком, индикатор, изменение цвета которого свидетельствует о разложении субстрата и образовании кислых продуктов.
Агар Эндо – плотная среда, применяется для выделения и первичной идентификации энтеробактерий. В состав ее входят, кроме питательной основы, лактоза и основной фуксин, обесцвеченный сульфитом и фосфатом натрия. Правильно приготовленная среда бесцветна или имеет слегка розовый оттенок. Колонии бактерий (кишечная палочка), ферментирующие лактозу, окрашиваются на ней в красный цвет; бактерии, не ферментирующие лактозу (сальмонеллы), остаются бесцветными.
Среда Левина (лактозоэозинметиленовый агар) – среда для выделения энтеробактерий. Колонии лактозоферментирующих бактерий окрашены в темно-синий или черный цвет, колонии лактозоотрицательных бактерий вырастают под цвет среды (светло-фиолетового цвета).
Среды Гисса – набор определенных углеводов для изучения ферментативной активности бактерий и их дифференциации по этим признакам.
Элективные питательные среды содержат дополнительные вещества, задерживающие рост грамположительных бактерий. Селективные питательные среды стимулируют рост одних микробов и угнетают рост других. Селективные условия получают путем добавления в среду химических веществ. Так как в этих средах патогенные бактерии размножаются и накапливаются, их называют также средами обогащения.
Среда Плоскирева – плотная питательная среда, содержащая соли желчных кислот, бриллиантовый зеленый, лактозу и индикатор. Эта среда является не только селективной, так как подавляет рост многих микробов и способствует лучшему росту возбудителей брюшного тифа, паратифов, дизентерии, но и дифференциально-диагностической, так как лактозоотрицательные бактерии (шигеллы) образуют на ней бесцветные колонии, а лактозоположительные – кирпично-красные.
Селенитовая среда - является лучшей средой обогащения для сальмонелл и дизентерийных микробов Зонне. Селенит натрия, содержащийся в среде, стимулирует рост этих бактерий и подавляет рост сопутствующей флоры.
Среда Мюллера служит для накопления сальмонелл. К питательной среде добавляют мел, раствор Люголя и гипосульфит натрия. При взаимодействии этих веществ образуется тетратионат натрия, который угнетает рост кишечных палочек, но создает благоприятные условия для размножения сальмонелл.
Висмут-сульфит агар (среда Вильсона-Блера) – содержит соли висмута, бриллиантовую зелень. Сальмонеллы растут на этой среде в виде колоний чернота цвета. Другие виды бактерий на этой среде роста не дают.
Желточно-солевой агар (ЖСА) – среда для выделения стафилококков, содержит до 10% хлорида натрия, что подавляет большинство бактерий, содержащихся в материале. Кроме того, эта среда является и дифференциально-диагностической, так как присутствие яичного желтка позволяет выявить фермент лецитиназу (лецитовителлазу), который образуют патогенные стафилококки. Лецитиназа расщепляет лецитин на фосфорхолины и нерастворимые в воде жирные кислоты, поэтому среда вокруг лецитиназоположительных колоний мутнеет и появляется опалесцирующая зона в виде «радужного венчика».
Теллуритовые среды (сывороточно-теллуритовый агар, кровяно-теллуритовый агар) – селективные среды для выделения дифтерийных бактерий, содержат теллурит калия. Бесцветная соль теллура, содержащаяся в питательной среде, восстанавливается дифтерийными бактериями до металла, окрашивающего колонии в черный цвет.
Щелочной агар элективен для холерных вибрионов, щелочная реакция среды (рН 9,0) не препятствует росту холерных вибрионов, но тормозит рост других микроорганизмов.
Консервирующие среды – среды, содержат добавки, предупреждающие размножение и гибель микробов, что способствует сохранению их жизнеспособности. Консервирующие среды применяются, когда нет возможности быстрого посева на питательные среды.
Для бактерий наиболее употребительны консерванты:
а) глицериновая смесь, состоящая из 0,5 л химически чистого глицерина и 1,0 л физиологического раствора;
б) боратная смесь;
в) фосфатно-буферная смесь.
Для длительного сохранения свежевыделенных и производственных культур применяют полужидкий голодный агар, в этой среде при пониженной жизнедеятельности микробов продукты обмена накапливаются незначительно, что способствует хорошему сохранению культур.
Специальные среды.
В бактериологии широко применяются сухие питательные среды промышленного производства, которые представляют собой гигроскопические порошки, содержащие все компоненты среды, кроме воды. Для их приготовления используются триптические перевары дешевых непищевых продуктов (рыбные отходы, мясокостная мука, технический казеин).
Они удобны при транспортировке, могут длительно храниться, избавляют лаборатории от громадного процесса приготовления сред, приближают к разрешению вопроса о стандартизации сред. Медицинская промышленность производит сухие среды Эндо, Левина, Плоскирева, висмутсульфит агар, питательный агар, углеводы с индикатором ВР и другие.
Термостаты
Для культивирования микроорганизмов используют термостаты.
Термостат – это аппарат, в котором поддерживают постоянную температуру. Прибор состоит из нагревателя, камеры, двойных стенок, между которыми циркулирует воздух или вода. Температура регулируется терморегулятором. Оптимальная температура для размножения большинства микроорганизмов 37°С.
Методика приготовления пластинчатого агара
МПА расплавляют на водяной бане, затем остужают до 50-55°С. Горлышко флакона обжигают в пламени спиртовки, открывают чашки Петри так, чтобы вошло горлышко флаконы, не прикасаясь к краям чашки, выливают 10–15 мл МПА, закрыв крышку, покачивают чашку, чтобы среда равномерно распределилась, оставляют на горизонтальной поверхности до застывания. После подсушивания чашки с пластинчатым агаром хранят на холоде.
Посев петлей
Стерильной остуженной петлей берут каплю материала, левой рукой приоткрывают один край чашки, вносят петлю внутрь и у противоположного края делают петлей несколько штрихов на одном месте, затем петлю отрывают и засевают материал параллельными штрихами от одного края чашки к другому с интервалом 5–6 мм. В начале посева, когда микробов на петле будет много, они дадут сливной рост, но с каждым штрихом микробов на петле остается все меньше, и они будут оставаться одиночными и давать изолированные колонии.
Посев по методу Дригальского
Этот метод используется при посеве материала, обильно обсемененного микрофлорой (гной, испражнения, мокрота). Для посева по методу Дригальского берут шпатель и несколько чашек (3–4). Шпатель – это инструмент, изготовленный из металлической проволоки или стеклянного дрота, загнутого в виде треугольника или Г-образно. Материал петлей или пипеткой вносят в первую чашку и равномерно распределяют шпателем по поверхности среды, этим же шпателем, не прожигая его, втирают материал в питательную среду во второй чашке, а затем – в третьей. При таком посеве в первой чашке будет сливной рост, а в последующих чашках вырастают изолированные колонии.
Выделение чистой культуры по Щукевичу
Для посева берут свежеприготовленную питательную среду с конденсатом. Исследуемый материал забирают петлей и вносят его осторожно, соблюдая правила асептики, не касаясь среды и стенок, в конденсационную воду. Бактерии с высокой подвижностью «выползают» на влажную поверхность скошенного агара.
В результате самостоятельной работы студент должен знать:
1. Классификацию, морфологию грибов, их методы изучения.
2. Классификацию и морфологию актиномицетов.
3. Правила противоэпидемических режимов и техники безопасности.
Уметь:
1. Дифференцировать микроорганизмы при микроскопии.
2. Микроскопировать окрашенные препараты.
3. Обеззараживать материал, обрабатывать руки дезинфирующими препаратами.
4. Приготавливать препараты из чистых культур.
Необходимость культивирования микробов связана не только с целью выделения возбудителя болезни из исследуемого материала и определения его вида, но и для накопления микробной массы при изготовлении биологических препаратов: вакцин, антигенов и аллергенов. Для культивирования микроорганизмов в лабораторных условиях применяют различные искусственные питательные среды.
Питательные среды бывают: по консистенции — жидкие, плотные, полужидкие; по происхождению — животного, растительного происхождения и синтетические среды постоянного состава; по назначению — обычные, или простые, для выращивания большинства микроорганизмов; специальные — для культивирования микробов, не растущих или плохо растущих на обычных питательных средах; дифференциально-диагностические — употребляемые для определения родовых или видовых особенностей исследуемых бактериальных культур (гемолитических, сахаролитических, протеолитических, редуцирующих и других свойств); селективные — для выделения микробов одного рода или вида из материала, содержащего смесь разных видов микроорганизмов, на которых одни виды хорошо растут, а другие не растут; среды обогащения (накопительные).
Основой многих питательных сред животного происхождения является мясная вода. Ее готовят из свежего нежирного говяжьего мяса, освобожденного от костей, фасций, сухожилий. Измельченное мясо (мелкие кусочки или фарш) заливают дистиллированной водой в соотношении 1 : 2 (на 1 кг мяса 2 л воды). Экстрагируют 12—24 ч, кипятят 1,5— 2 ч, фильтруют, добавляют дистиллированной воды до первоначального объема, разливают в бутыли, колбы, закрывают ватно-марлевыми пробками и стерилизуют в автоклаве.
Обычные (простые) среды.
Мясо-пептонный бульон (МПБ) — жидкая питательная среда. Для его приготовления к 1 л мясной воды добавляют 1% пептона, 0,5% химически чистой поваренной соли и кипятят. Мясная вода слабокислой реакции, поэтому МПБ подщелачивают — добавляют небольшое количество 10— 15%-ного раствораКОН или NaOH, кипятят 2—3 мин, проверяют рН при помощи компаратора Михаэлнса (рис. 30) или электропотенциометром. Мясо-пептонный бульон фильтруют через бумажный фильтр, разливают по пробиркам, автоклавируют.
Мясо-пептонный агар (МПА) — плотная питательная среда. К МПБ добавляют 2% агар-агара (без-азотистое органическое вещество, полученное из морских водорослей) и кипятят до его расплавления, в горячем виде устанавливают рН, кипятят 5—10 мин, фильтруют в горячем виде через ватно-марлевый фильтр, разливают в пробирки или колбочки, автоклавируют. После стерилизации горячие пробирки с агаром раскладывают наклонно под углом 5—6°. При застывании образуется скошенная плотная поверхность.
Мясо-пептонный полужидкий агар готовят так же, как и МПА; различие заключается в том, что агар-агара добавляют меньше — 0,15—0,20—0,25%.
Специальные питательные среды.
Бульон Мартена. Свиные желудки (или сычуги рогатого скота) очищают от жира, фасций, измельчают в мясорубке, заливают водой 1 : 4 и добавляют 1% (кобъему жидкости)соляной кислоты. Смесь выдерживают при 50° 24 ч, нейтрализуют 20%-ным раствором NaOH до щелочной реакции по лакмусу, автоклавируют при 120° 15 мин. Для приготовления бульона смешивают равные количества мясной воды и полученной смеси, кипятят 10 мин, подщелачивают 20%-ным раствором NaOH до рН 7,9, кипятят 30 мин, фильтруют, разливают в пробирки, автоклавируют при 0,5 атм (110°) 30 мин.
Добавление 2% агара обеспечивает получение плотной среды — агар Мартена.
Бульон Хоттингера готовят из триптического гидролизата (перевара) мясных отходов — фасций, жира, сухожилий. .1 кг мясных обрезков заливают 2 л кипящеЙ воды, кипятят 5 мин, охлаждают до 45° и добавляют 5,0—10,0 панкреатина, подщелачивают до рН 7,8—8,0 углекислым натром, встряхивают и доливают хлороформ (10 мл на 1 л), плотно закрывают, выдерживают в теплом месте 10 дней, ежедневно встряхивая. Полученный перевар подкисляют соляной кислотой до рН 5,5. Хранят в темном месте. Для приготовления питательной среды к 1 л воды добавляют 100—200 мл полученного перевара, кипятят 1—2 мин, фильтруют, подщелачивают, стерилизуют. Агар Хоттингера готовят так же, как и обычный МПА.
Сахарный (глюкозный) бульон (или агар) изготавливают как обычные среды, но к ним добавляют 1—2% глюкозы и стерилизуют текучим паром или автоклавируют при 0,5 атм.
Мясо-пептонная желатина. К МПБ добавляют 10—20% желатины (продукт, получаемый из клейдающих тканей животных), расплавляют и в горячем виде устанавливают нужную реакцию среды, пропускают через ватно-марлевый фильтр, разливают в пробирки, стерилизуют текучим паром дробно.
Мясо-пептонный печеночный бульон Китт — Тароцци — жидкая среда для культивирования анаэробов. Печень крупного рогатого скота нарезают мелкими кусочками, заливают водой 1:1, кипятят, фильтруют и печеночную воду добавляют к МПБ 2 : 1 (на 2 л МПБ 1 л печеночного отвара), кипятят, устанавливают рН, разливают по пробиркам высоким столбиком, в которые предварительно положены кусочки вареной печени. В пробирки поверх среды наливают 1—2 мл вазелинового масла и стерилизуют в автоклаве при 0,5 атм 30 мин.^
Сывороточный бульон и сыворо-точный мясо-пептонный агар готовят путем асептического добавления к МПБ или расплавленному н охлажденному до 45—50° МПА 5—10% стерильной сыворотки крови лошади (или барана, кролика), затем сывороточный бульон разливают в стерильные пробирки (колбы).
Сывороточный МПА разливают или в пробирки (столбиком) . или в чашки Петри.
Дифференциально-диагностические среды. Кровяной МПА применяют для выявления гемолитических свойств бактерий. Предварительно в стерильную колбочку со стеклянными бусами асептично берут кровь (у барана, лошади или кролика), встряхивают 15—20 мин, чтобы фибрин отделить от остальной массы крови. Фибрин сгустками осаждается на бусах и дефибринированную кровь (5—10%) стерильно добавляют к расплавленному и остуженному МПА, легким вращением колбочки равномерно смешивают и разливают в стерильные чашки Петри.
Среды Гисса. В пептонную воду (состоящую из дистиллированной воды, 0,5% NaCl и 1% пептона) добавляют 0,5% углевода (сахар или многоатомный спирт) и 0,5% индикатора Андрэдэ. Обычно готовят набор сред с разными углеводами, каждый в отдельности. Используемый индикатор представляет собой 0,5 г кислого фуксина, 16 мл 4%-ного раствора NaOH, 100 мл дистиллированной воды. Среды с углеводами разливают в пробирки с «газовками» (поплавками), опущенными в пробирки вверх дном. Стерилизуют среды с углеводами текучим паром дробно. . Среды Гисса могут быть жидкие и полужидкие- (без газовок), содержащие 0,25% агара. При ферментации того или _иного углевода микробом, растущим в данной среде, образуется кислота, под действием которой восстанавливается цвет краски индикатора. Среда приобретает красный цвет. Образовавшиеся прн ферментации углевода газообразные продукты скапливаются в поплавках.
Среда Эндо. В расплавленный МПА (рН 7,4— 7,6) вносят 0,5—1% лактозы и 0,5% насыщенного спиртового раствора основного фуксина, обесцвеченного добавлением по каплям 10%-ного сернокислого натрия. Среду кипятят и разливают в чашки Петри. Бактерии, сбраживающие лактозу, на этой среде растут в виде красных колоний.
Среда Левина. Готовят 2%-ный агар на бульоне Хоттингера, рН 7,2—7,4, стерилизуют в автоклаве. К 100 мл готового расплавленного агара добавляют: 2 мл 0,5%-ного раствора метиленовой синьки, 1,5 мл 2%-ного эозина (щелочного бактериологического), 2 г лактозы и 0,2 г двуосновного фосфорнокислого калия (КаНРО4). Растворы красителей готовят на дистиллированной воде и стерилизуют в аппарате Коха. Раствор метиленовой синьки перед употреблением подогревают на водяной бане и добавляют к агару в теплом виде. После добавления этих компонентов среду тщательно перемешивают и разливают в чашки Петри. Среда фиолетового цвета.
Висмут-сульфит агар (среда Вильсон— Блера). МПА (рН 7,5) с индикатором, содержащим лимонно-кислый висмут, сернокислый натрий, соль Мора (серноаммонийная соль железа), двуосновной фосфорнокислый натрий, глюкозу и бриллиантовую зелень. В настоящее время висмут-сульфит агар (как и агар Эндо, среду Плоскирева) промышленность выпускает в сухом порошкообразном виде. 6 г сухого порошка растворяют в 100 мл дистиллированной воды, подогревают при непрерывном помешивании, разливают в стерильные пробирки и оставляют в наклонном положении. Применяют также среды с химическими веществами, которые изменяют окраску в результате окислительно-восстановительных (редуцирующих) процессов, обусловленных ферментами бактерий. . Для этого готовят молоко с метиленовой си нько й. Свежее обезжиренное коровье молоко подщелачивают двууглекислым натром до слабощелочной реакции по лакмусовой бумажке, добавляют 1%-ный водный раствор метиленовой синьки да голубого окрашивания. Стерилизуют текучим паром дробно.
Если есть предположение, что в исследуемом материале имеется небольшое количество бактерий, то рекомендуют использовать среды накопления (обогащения). С р ед а Шустовой: к МПА (рН 7,4) добавляют 10% 50%-ного водного раствора гипосульфита и 2% раствора Люголя. Применяют для накопления бактерий паратифа. Среда Раппопорт: к МПБ добавляют 1% глюкозы, 10% желчи и 1% индикатора Андрэде. Стерилизуют текучим паром.
Синтетические среды применяют для изучения метаболизма бактерий и других биологических особенностей. Их составляют из химически чистых растворимых в воде веществ, в строго определенных количествах: фосфорнокислого аммония, фосфорнокислого калия, хлористого натра, сернокислого магния, глюкозы или другого углевода, никотинамида и др. По мере необходимости готовят плотные синтетические среды путем добавления агара. Стерилизуют в автоклаве. (Синтетические среды Моделя, Соттона
Для культивирования дрожжей и плесневых грибов используют следующие среды
Синтетическая среда Ван-Итерсона : азотнокислого аммония (NaH4NO3) 0,5, калия фосфорнокислого одноосновного (КН2РО4) 0,5, воды водопроводной 1 л. Автоклавируют при 1 атм 20 мин.
Глюкозный агар Сабуро: глюкозы 4,0, пептона 1,0, агара 1,8, воды 100 мл. Стерилизуют автоклавироваиием.
Агар Литмана с бычьей желчью: пептона 10,0, глюкозы 10,0, обезвоженной бычьей желчи 15 мл, кристаллвиолета 0,01, воды 1 л, агара 20,0. Стерилизуют в автоклаве при 1 атм 15 мин. Разливают в*чашки толстым слоем, чтобы предупредить обезвоживание среды.
Сахарный бульон применяют для культивирования широкого круга микроорганизмов. Сахарный агар используют для приготовления кровяного сахарного агара.
Состав**:
** Состав выверен и доведен до соответствия необходимым параметрам
Приготовление:
Размешать 43,0 г порошка М084 или 23,0 г порошка М044 в 1000 мл дистиллированной воды. Подогреть до кипения для полного растворения частиц. Стерилизовать автоклавированием при 1,1 атм (121°С) в течение 15 мин. При желании из Сахарного агара можно получить кровяной сахарный агар. Для этого в стерильный Сахарный агар, остуженный до 50°С, добавить (до 5% об/об) стерильную дефибринированную баранью кровь. Тщательно перемешать и разлить в соответствующие емкости.
Принцип и оценка результата:
Сахарный бульон применяют для культивирования широкого круга микроорганизмов и специально используют для приготовления кровяного сахарного агара (1). Сахарный бульон применяют для определения чувствительности микроорганизмов к антибиотикам методом серийных разведений (2). Этот бульон обладает преимуществом, по сравнению с соево-пептонной средой, особенно при определении чувствительности к неомицину и хлортетрациклину.
Сахарный агар имеет высокую концентрацию глюкозы, являющейся источником энергии для быстрого роста микроорганизмов. Вместе с тем, ввиду высокого содержания углевода среда не очень подходит для определения гемолиза. Мясной экстракт и триптоза служат источником азотистых веществ, серы, углерода, витаминов и солей. Хлорид поддерживает оптимальное осмотическое давление.
Контроль качества:
Внешний вид порошка:
Гомогенный сыпучий светло-желтый порошок.
Плотность готовой среды:
Образуется среда, соответствующая по плотности 1,5%-ному агаровому гелю (М084).
Цвет и прозрачность готовой среды:
Среда имеет светло-желтую окраску, прозрачна или слегка опалесцирует, если гель образуется в чашках Петри или пробирках.
Кислотность среды:
При 25°С водный раствор М084 (4,3% вес/об) имеет рН 7,3 ± 0,2, М044 (2,3% вес/об) имеет рН 7,2 ± 0,2.
Культуральные свойства:
Ростовые характеристики референс-штаммов через 18-24 ч при 35-37°С.
Различают два основных варианта метода серийных разведений в бульоне: макрометод (пробирочный) и микрометод (при величине конечного объема 0,2 мл и меньше). Область применения макрометода из-за низкой производительности ограничивается случаями необходимости оценки чувствительности единичных штаммов.
Макрометод
Процедура
Тестирование проводится в объеме 1 мл каждого разведения АБП с конечной концентрацией исследуемого микроорганизма примерно 5 x 10 5 КОЕ/мл.
Питательная среда
Питательный бульон для определения чувствительности разливают по 0,5 мл в каждую пробирку. Количество пробирок определяется необходимым диапазоном разведений АБП и увеличивается на одну для постановки "отрицательного" контроля.
Приготовление серийных разведений АБП (рис. 1)
Рабочий раствор АБП готовят из основного раствора с использованием жидкой питательной среды. Концентрацию рабочего раствора рассчитывают исходя из необходимой максимальной концентрации в ряду серийных разведений, учитывая фактор разбавления препарата при последующей инокуляции. Затем рабочий раствор в количестве 0,5 мл при помощи микропипетки со стерильным наконечником вносят в первую пробирку, содержащую 0,5 мл бульона. Тщательно перемешивают и новым стерильным наконечником переносят 0,5 мл раствора АБП в бульоне во вторую пробирку, содержавшую первоначально 0,5 мл бульона. Эту процедуру повторяют, пока не будет приготовлен весь необходимый ряд разведений. Из последней пробирки 0,5 мл бульона удаляют.
Таким образом, получается ряд пробирок с растворами АБПов, концентрации которых отличаются в соседних пробирках в 2 раза. Одновременно готовятся дополнительные ряды серийных разведений АБП для тестирования контрольных штаммов. Серия разведений обязательно должна включать в себя пограничные концентрации и допустимые диапазоны МПК для контрольных штаммов.
Приготовление инокулюма и инокуляция
Для инокуляции используют стандартную микробную взвесь, эквивалентную 0,5 по стандарту МакФарланда, разведенную в 100 раз на питательном бульоне, после чего концентрация микроорганизма в ней составит примерно 10 6 КОЕ/мл.
По 0,5 мл инокулюма вносят в каждую пробирку, содержащую по 0,5 мл соответствующего разведения АБП, и в одну пробирку с 0,5 мл питательного бульона без антибиотика ("отрицательный" контроль). Конечная концентрация микроорганизма в каждой пробирке достигнет необходимой - примерно 5 x 10 5 КОЕ/мл. Инокулюм должен быть внесен в пробирки с разведениями АБП не позднее 15 - 30 мин. с момента приготовления.
Инкубация
Пробирки закрывают стерильными ватно-марлевыми пробками или металлическими колпачками, и все пробирки с тестируемыми штаммами, кроме пробирки "отрицательный" контроль, инкубируются в обычной атмосфере при температуре 35 °С в течение 16 - 20 или 20 - 24 ч (в зависимости от вида тестируемого микроорганизма). Пробирка "отрицательный" контроль помещается в холодильник при + 4 °С, где хранится до учета результатов.
Учет результатов
Для определения наличия роста микроорганизма пробирки с посевами просматриваются в проходящем свете. Рост культуры в присутствии АБП сравнивается с референтной пробиркой ("отрицательный" контроль), содержащей исходный инокулюм и хранившейся в холодильнике. МПК определяется по наименьшей концентрации АБП, которая подавляет видимый рост микроорганизма.
Рисунок 1

Микрометод
Преимуществами микрометода является высокая производительность и возможность длительного хранения заранее приготовленных планшетов. Тестирование проводится при величине конечного объема 0,2 мл и меньше, что позволяет значительно сократить количество расходных материалов. Методика не имеет отличий от макрометода, за исключением используемых объемов питательного бульона с разведениями антибиотиков и инокулюма, но требует дополнительного оснащения лаборатории многоканальными пипетками, 96-луночными планшетами для иммунологических исследований (с плоским дном) со стерильными крышками.
Первым этапом является изготовление планшетов, пригодных для хранения. После внесения рабочих растворов антибиотиков в лунки, запаянные в полиэтилен планшеты могут храниться при температуре ниже - 60 °С до момента использования. Повторное замораживание-оттаивание не допускается.
Для проведения исследования планшеты после извлечения из холодильника выдерживают до достижения ими комнатной температуры, после чего проводят инокуляцию приготовленной суспензией исследуемого микроорганизма. При проведении инкубации планшет обязательно должен быть закрыт крышкой для предотвращения высыхания содержимого лунок.
Учет результатов проводят визуально или спектрофотометрически, сравнивая рост микроорганизма в присутствии АБП с ростом культуры в ячейке без АБП. За МПК принимают минимальную концентрацию, обеспечивающую полное подавление видимого роста исследуемого штамма.
Метод серийных микроразведений в бульоне легко поддается модификациям для разработки коммерческих тест-систем. При использовании коммерческих тест-систем следует пользоваться инструкциями изготовителей.
Контроль качества
При постановке методов серийных разведений в бульоне необходимо проводить контроль роста культуры в среде без АБП. Необходимо также контролировать чистоту суспензии микроорганизма, использованной для инокуляции, путем высева на неселективные среды. Каждая партия тестируемых штаммов сопровождается внутренним контролем качества исследования с использованием соответствующих контрольных (референтных) штаммов.
Рецепт 67. Сахарный бульон (бульон с глюкозой). К МПБ с pH 7,4(±0,2) прибавляют глюкозу в количестве 0,5-1%. Перед добавлением глюкозу растворяют в небольшом количестве дистиллированной воды. Приготовленную среду стерилизуют три дня подряд текучим паром по 30 мин или однократно в автоклаве при 115°С в течение 30 мин. Глюкозу можно добавлять ex tempore используя 40 % стерильный раствор.
Бульон предназначен для выращивания кокков.
Рецепт 68. Сахарный агар (агар с глюкозой). Плотная среда предназначена для выращивания кокков.
К расплавленному мясопептонному агару прибавляют 0,5-1 % глюкозы, предварительно растворенной в небольшом количестве дистиллированной воды. Приготовленную среду стерилизуют текучим паром дробно три дня подряд по 20 мин или 15 мин в автоклаве при 115°С. Глюкозу можно добавлять ex tempore используя 40 % стерильный раствор.
Рецепт 69. Реактивы на оксидазу (цитохромоксидазу):
1. Реактив Kovacs (готовят ex tempore):
Тетраметил-n-фенилендиамина гидрохлорид — 0,5 г
Вода дистиллированная — до 100 мл
Каждый раз перед постановкой теста реактивы на оксидазу следует испытывать с тест-культурами, дающими положительную (Р. aeruginosa, Р. fluorescens) и отрицательную (Е. coli) оксидазную реакцию.
2. Реактив Gaby, Hadley (для постановки оксидазного теста):
Раствор А.
а-нафтол — 1,0 г
Спирт этиловый (95—96 %) — до 100 мл
Раствор Б.
N,N-диметил-n-фенилендиамин — 1,0 г
(можно заменить n-амино-диметил-анилин гидрохлоридом в том же количестве)
Спирт этиловый (95—96 %) — до 100 мл
Растворы сохраняются в темных флаконах с притертыми пробками: раствор А—до 1 мес., раствор Б — до 1 нед. Перед употреблением к трем частям раствора А добавляют семь частей раствора Б.
Редактор: Искандер Милевски. Дата публикации: 13.09.2019
Питательные среды в микробиологии — это субстраты, на которых выращивают микроорганизмы и тканевые культуры. Они применяются для диагностических задач, выделения и изучения чистых культур микроорганизмов, получения вакцин и лекарств, для других биологических, фармацевтических и медицинских целей.
Классификация микробиологических питательных сред
В микробиологии питательные среды разделяют на: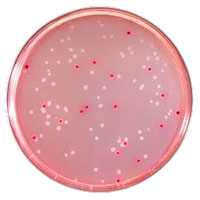
— среды определенного и неопределенного состава;
— натуральные, полусинтетические и синтетические;
— основные, диагностические, элективные;
— плотные, полужидкие, жидкие, сухие, сыпучие.
Натуральными питательными средами называют те, что получают из природных материалов: крови, мяса, белков, органов животных, растительных экстрактов и растительного сырья. Примером таких сред могут быть мясной бульон, молочная сыворотка, пивное сусло, настои сена, агар-агар, кровь, желчь. Натуральные среды относятся к средам с неопределенным составом, который в разное время могут иметь разное количество тех или иных компонентов.
Полусинтетические среды тоже считаются средами с неопределенным составом. Они готовятся на основе натуральных питательных сред, но в них добавляются вещества, которые гарантируют культурам активное размножение. На полусинтетических средах выращивают культуры для получения витаминов, аминокислот, антибиотиков в промышленной фармацевтике.

Синтетические среды готовят из ингредиентов известного состава, в известной концентрации и соотношениях, поэтому эти среды относятся к средам определенного состава. С их помощью изучают метаболизм микроорганизмов, их биологические и физиологические свойства, возможность получения веществ, подавляющих или, наоборот, стимулирующих их развитие.
Основные, элективные и диагностические питательные среды
Основные среды служат для выращивания различных микробных культур, а также как основа для получения элективных и диагностических сред. К основным средам, например, относится мясной бульон, мясной агар, сусло, бульон Хоттингера. Для разных культур в основные среды добавляют некоторые компоненты для стимулирования роста — это могут быть витамины, аминокислоты, природные экстракты. Так, возбудитель коклюша выращивается на среде с добавлением крови.
Элективные среды — среды для избирательного (селективного) выращивания биологических культур. Состав среды подбирается так, чтобы быть оптимальным для одного вида или группы близкородственных бактерий и подавлять развитие бактерий других видов. Например, добавление в среду хлористого натрия 
в определенной концентрации подавляет рост всех бактерий, кроме стафилококков. С помощью элективных культур получают чистые культуры для дальнейшего размножения и накопления.
Диагностические среды служат для идентификации микроорганизмов. По изменению среды и ее химического состава (изменению окраски среды, появлению пузырьков газа и т.п.) определяют вид бактерий. В такие среды часто добавляют химические красители-индикаторы, такие как кристаллический фиолетовый, малахитовый зеленый, метиленовый синий, фусин и другие. Они помогают разделить близкие культуры. Скажем, в розовой среде Эндо, подкрашенной фусином, кишечная палочка образует колонии красного цвета, а тифозные и дизентерийные колонии бактерий — бесцветные.
У нас Вы можете купить «Питательный бульон для культивирования микроорганизмов» (ГРМ-бульон)». Питательный ГРМ-бульон для культивирования микроорганизмов сухой представляет собой мелкодисперсный, гигроскопичный порошок светло-желтого цвета. Предназначен для культивирования различных микроорганизмов, таких как: энтеробактерии, синегнойная палочка, стафилококки, а также для проведения исследований в санитарной и клинической микробиологии.
ТУ 9398-021-78095326-2006 РУ № ФСР 2007/00002.
Состав: пептон ферментативный, панкреатический гидролизат рыбной муки, натрий хлористый.
Приготовление: 20,0 г порошка размешивают в 1 л дистиллированной воды, кипятят в течение 3 мин, фильтруют через бумажный фильтр, разливают по 10,0 мл в стерильные пробирки и стерилизуют автоклавированием при температуре 121 o С в течение 15 мин. Готовая питательная среда прозрачная, желтого цвета. Готовую среду можно использовать в течение 1 месяца при условии хранения ее при температуре 2-8 °С, pH 7,2±0,2.
Принцип действия: совокупность компонентов, входящих в состав среды, обеспечивает питательные потребности для визуального обнаружения роста культур по помутнению среды.
Проведение анализа: исследования образцов проводятся по соответствующим Методическим указаниям . Инкубируют при температуре (37±1) o С в течение 24-48 ч.
| Тест штамп | Наблюдаемый эффект |
|---|---|
| Shigella flexneri 1а 8516 | Образование индола (розовое окрашивание индикаторной бумаги) |
| Salmonella typhi Н901 ГДР/ГИСК | Образование сероводорода (почернение индикаторной бумаги) |
| Corynebacterium xerosis 1911 | Диффузное помутнение среды |
| Staphylococcus aureus Wood-46 | Диффузное помутнение среды |
| Pseudomonas aeruginosa 27/99 | Диффузное помутнение среды |
| Escherichia coli 3912/41 (055:K59) | Диффузное помутнение среды |
Упаковка: полиэтиленовые банки.
Фасовка по 0,25кг для приготовления 12,5 л среды.
Кат. № О2


Цена: 4 230.80 RUB
Вы можете добавить товар в корзину, указав количество
Производитель: Оболенск
Страна: Россия
Вид упаковки: полиэтиленовая банка
Артикул: О2
Сухой питательный бульон (СПБ) в виде порошка для приготовления бактериологических неселективных сред общего назначения для различных микроорганизмов, при необходимости могут быть дополнительно внесены ингибирующие и обогатительные добавки. Флакон 250 гр рассчитан на приготовление 6,2 л жидкой среды
Функциональное назначение
Универсальная основа из ферментативного пептона и гидролизата с хлоридом натрия, составляющие основу любой микробиологической среды, обеспечивают необходимыми питательные компонентами для развития неприхотливых культур. Появление диффузного помутнения свидетельствует о присутствии, например, С. xerosis, S. aureus, Е. coli, P.aeruginosa; S. pyogenes - в виде придонно-пристеночного роста с возможным слабым рассеянным помутнением. С помощью индикаторных полосок, можно определить газ, выделяемый при росте культуры, например, индола у S. flexneri или сероводорода S. typhi. Полученные взвеси пересевают на более селективные дифференциально-диагностические среды
Технические характеристики
Состав среды, гамм/литр:
пептон ферментативный 8,0;
панкреатический гидролизат рыбной муки 8,0
натрий хлористый 4,0.
Внешний вид: мелкодисперсный гомогенный сухой, легко растворимый порошок светло-желтого цвета.
Готовая среда желтого цвета, прозрачная.
Кислотность среды: при 25°С имеет рН 7,2±0,2.
Форма выпуска: сухой порошок в полиэтиленовых банках по 250 г.
Условия хранения: в герметично закрытой упаковке в сухом защищенном от света месте при температуре +2. 30°C.
Срок годности - 5 лет с даты производства, указанной на упаковке.
Регистрационное удостоверение № ФСР 2007/00002
Документация и инструкции
![]()
регистрационное удостоверение (909.5 KB)![]()
инструкция по применению (46 KB)
Вся представленная на сайте информация, касающаяся технических характеристик, наличия на складе, стоимости товаров, носит ознакомительный характер и ни при каких условиях не является публичной офертой, определяемой положением пунктом 2 статьи 437 Гражданского кодекса Российской Федерации. Всю подробную информацию о товарах, их наличии и стоимости Вы можете получить у менеджеров отдела клиентского сервиса.
На данном сайте используются файлы cookie (куки) в целях совершенствования работы сайта и получения аналитической информации. В случае несогласия, просим произвести соответствующие настройки в браузере или покинуть данный сайт. Оставаясь на www.art-medika.com, Вы принимаете нашу политику конфиденциальности. Заполняя форму заявки, Вы подтверждаете свое согласие на обработку персональных данных.
© 2012-2019 Арт-Медика оборудование, реагенты, изделия медицинского назначения для клинической лабораторной диагностики
Селенитовый бульон — среда обогащения с селективными свойствами, предназначенная для выделения патогенной бактерий рода сальмонелла (лат. Salmonella). Она очень эффективна при необходимости обнаружить именно этот патогенный организм в числе других представителей кишечной микрофлоры. Среда используется как для клинической диагностики, так и в санитарных целях при проверке пищевых продуктов.
Общая характеристика
Селенитовый бульон готовится на основе порошка, представляющего собой гомогенизированную смесь различных компонентов состава. Цвет сухого материала может быть светло-желтым или кремовым, в зависимости от типа среды. Порошок обладает сыпучими свойствами.
Готовый селенитовый бульон представляет собой жидкую прозрачную среду светло-желтого цвета. Эта масса заливается в емкости, куда производится посев для дальнейшей инкубации.

Существует три основных вида селенитового бульона:
- среда в чистом виде — подходит для выделения сальмонелл как из клинического, так и из санитарного материала;
- с добавлением маннита (двухкомпонентный бульон) — предназначен для работы только с клиническим материалом;
- цистеин-селенитовая среда — может использоваться для выделения сальмонелл из патологического биоматериала пациента (кал, моча и др).
Эти типы немного отличаются компонентным составом и особенностями действия.
Основная задача селенитового бульона — способствовать накоплению сальмонелл, подавляя рост сопутствующей микрофлоры. Это дает возможность не только обнаружить патоген в материале, но и впоследствии пересеять его на агар. Среда была разработана Лейфлером, который первым обнаружил селективное действие селенита в отношении сальмонелл.
Состав
В состав селенитового бульона входят:
- гидролизат казеина;
- лактоза;
- фосфат натрия;
- гидроселенит натрия.
Селенит-цистеиновая среда, кроме этих компонентов, содержит L-цистеин и гидрофосфат натрия. Состав бульона с маннитом отличается тем, что вместо гидролизата казеина туда входит пептический перевар животной ткани. Лактоза в такой среде отсутствует, но зато есть маннит. Последний выступает в качестве ферментируемого субстрата и обеспечивает буферные свойства бульона.
Все компоненты порошка, кроме гидроселенита натрия, условно называют частью А, а селективное вещество — частью Б.
Принцип действия и свойства среды
Селенитовый бульон работает как накопительная среда с селективным действием. Избирательный эффект обеспечивается за счет токсичности селенита, который подавляет рост большинства микроорганизмов. При этом бактерии рода сальмонелла способны восстанавливать это соединение, тем самым устраняя токсический эффект для собственных клеток. Однако в результате реакции образуется щелочь, которая снижает пагубное влияние селенита на рост сопутствующей микрофлоры, в связи с чем возникает необходимость стабилизировать pH. Эту функцию выполняют бактерии, ферментирующие лактозу с образованием кислоты. Буферность среды обеспечивается фосфатом.
В двухкомпонентном бульоне pH стабилизируется за счет маннита. Среда с цистеином улучшает селективное действие в отношении сальмонелл. Такой бульон эффективен для контроля инфекционного фона у пациентов с неострой стадией заболевания или реконвалесцентов.

Проявление ростовых характеристик референтных штаммов в среде можно наблюдать по истечении 12-24 часов с момента начала инкубации. При этом сальмонеллы образуют бесцветные колонии.
Особенности приготовления
Приготовление среды осуществляют в два этапа. Вначале делают раствор с селективным компонентом из расчета 4 грамма селенита натрия на литр дистиллированной воды. Затем добавляют 19 грамм основного порошка (часть А). Раствор тщательно перемешивают и подогревают до полного растворения частиц, после чего заливают в стерильные пробирки.

При приготовлении важно следить за температурным режимом, поскольку среда неустойчива к перегреву. Стерилизацию бульона можно осуществлять только на водяной бане или же использовать струю пара. Автоклавирование среды категорически недопустимо.
Читайте также:








