Желчный бульон для выделения сальмонелл
Селенитовый бульон — среда обогащения с селективными свойствами, предназначенная для выделения патогенной бактерий рода сальмонелла (лат. Salmonella). Она очень эффективна при необходимости обнаружить именно этот патогенный организм в числе других представителей кишечной микрофлоры. Среда используется как для клинической диагностики, так и в санитарных целях при проверке пищевых продуктов.
Общая характеристика
Селенитовый бульон готовится на основе порошка, представляющего собой гомогенизированную смесь различных компонентов состава. Цвет сухого материала может быть светло-желтым или кремовым, в зависимости от типа среды. Порошок обладает сыпучими свойствами.
Готовый селенитовый бульон представляет собой жидкую прозрачную среду светло-желтого цвета. Эта масса заливается в емкости, куда производится посев для дальнейшей инкубации.

Существует три основных вида селенитового бульона:
- среда в чистом виде — подходит для выделения сальмонелл как из клинического, так и из санитарного материала;
- с добавлением маннита (двухкомпонентный бульон) — предназначен для работы только с клиническим материалом;
- цистеин-селенитовая среда — может использоваться для выделения сальмонелл из патологического биоматериала пациента (кал, моча и др).
Эти типы немного отличаются компонентным составом и особенностями действия.
Основная задача селенитового бульона — способствовать накоплению сальмонелл, подавляя рост сопутствующей микрофлоры. Это дает возможность не только обнаружить патоген в материале, но и впоследствии пересеять его на агар. Среда была разработана Лейфлером, который первым обнаружил селективное действие селенита в отношении сальмонелл.
Состав
В состав селенитового бульона входят:
- гидролизат казеина;
- лактоза;
- фосфат натрия;
- гидроселенит натрия.
Селенит-цистеиновая среда, кроме этих компонентов, содержит L-цистеин и гидрофосфат натрия. Состав бульона с маннитом отличается тем, что вместо гидролизата казеина туда входит пептический перевар животной ткани. Лактоза в такой среде отсутствует, но зато есть маннит. Последний выступает в качестве ферментируемого субстрата и обеспечивает буферные свойства бульона.
Все компоненты порошка, кроме гидроселенита натрия, условно называют частью А, а селективное вещество — частью Б.
Принцип действия и свойства среды
Селенитовый бульон работает как накопительная среда с селективным действием. Избирательный эффект обеспечивается за счет токсичности селенита, который подавляет рост большинства микроорганизмов. При этом бактерии рода сальмонелла способны восстанавливать это соединение, тем самым устраняя токсический эффект для собственных клеток. Однако в результате реакции образуется щелочь, которая снижает пагубное влияние селенита на рост сопутствующей микрофлоры, в связи с чем возникает необходимость стабилизировать pH. Эту функцию выполняют бактерии, ферментирующие лактозу с образованием кислоты. Буферность среды обеспечивается фосфатом.
В двухкомпонентном бульоне pH стабилизируется за счет маннита. Среда с цистеином улучшает селективное действие в отношении сальмонелл. Такой бульон эффективен для контроля инфекционного фона у пациентов с неострой стадией заболевания или реконвалесцентов.

Проявление ростовых характеристик референтных штаммов в среде можно наблюдать по истечении 12-24 часов с момента начала инкубации. При этом сальмонеллы образуют бесцветные колонии.
Особенности приготовления
Приготовление среды осуществляют в два этапа. Вначале делают раствор с селективным компонентом из расчета 4 грамма селенита натрия на литр дистиллированной воды. Затем добавляют 19 грамм основного порошка (часть А). Раствор тщательно перемешивают и подогревают до полного растворения частиц, после чего заливают в стерильные пробирки.

При приготовлении важно следить за температурным режимом, поскольку среда неустойчива к перегреву. Стерилизацию бульона можно осуществлять только на водяной бане или же использовать струю пара. Автоклавирование среды категорически недопустимо.
Основная особенность готовых питательных сред производства НИЦФ заключена не только в широкой номенклатуре и удобстве применения, но, прежде всего, в характеристиках качества. Для их изготовления используется высококачественное сырье - мясо КРС, а не заменители, оно проходит углубленный и многофакторный контроль. Наконец, готовые питательные среды делаются «под заказ», очень ограниченными сериями, что также влияет на показатели качества. Все это вместе взятое определяет преимущество и перспективу готовых питательных сред.
Наименование
ПИТАТЕЛЬНЫЕ СРЕДЫ ОБЩЕГО НАЗНАЧЕНИЯ
К этой группе сред относятся мясо-пептонный агар (МПА), мясо-пептонный бульон (МПБ), плотные и жидкие среды Хоттингера с различным содержанием аминного азота, Колумбийский агар, а также получившие в последнее время большое распространение казеиново-соевые среды - "триптон-соевые" и "трипказо-соевые" бульоны и агары.
НИЦФ предлагает два варианта МПА и МПБ: изготовленные на основе говяжьего мяса и гидролизата кильки. Первый вариант адекватен классической прописи этих сред с включением пептона и мясной воды.
Казеиново-соевые среды являются альтернативой хорошо известным МПА и МПБ - в качестве источников белка они содержат гидролизаты соевой муки и казеина. Применение этих источников белка вместо мяса значительно удешевляет среды, не ухудшая их качества.
Мясо-пептонный бульон на основе мяса говяжьего (МПБ). Базовая питательная среда для широкого круга микроорганизмов.
Мясо-пептонный бульон на основе мяса говяжьего с добавлением глюкозы. Базовая питательная среда для широкого круга микроорганизмов.
Мясо-пептонный агар на основе мяса говяжьего (МПА). Базовая питательная среда для широкого круга микроорганизмов.
Мясо-пептонный агар на основе мяса говяжьего с добавлением глюкозы. Базовая питательная среда для широкого круга микроорганизмов.
Питательный бульон на основе гидролизата кильки или рыбной муки.
Питательный агар на основе гидролизата кильки или рыбной муки.
Колумбийский агар. Обогащенный вариант питательного агара.
Бульоны Хоттингера 33, 100, 120, 140, 160 мг % аминного азота для микробов с различными ростовыми требованиями
Агар ы Хоттингера 33, 100 мг % аминного азота.
Пептонная вода 1 , 13 %
Полужидкий агар для хранения культур микроорганизмов
Флаконы, пробирки с 10 мл среды под каучуковой или ватно-марлевой пробкой
Кровяной агар (колумбийский агар с бараньей кровью), приготовлен на основе МПА из мяса говяжьего
Чашки Петри 90мм и 100 мм
Колумбийский агар (питательная основа среды для выделения стрептококков)
Комплект для приготовления шоколадного агара с витаминно-ростовой добавкой для культивирования гемофильных бактерий
Комплект для приготовления 200 мл среды
ПИТАТЕЛЬНЫЕ СРЕДЫ ДЛЯ ВЫДЕЛЕНИЯ И КУЛЬТИВИРОВАНИЯ ЭНТЕРОБАКТЕРИЙ
Глюкозопептонная среда (Эйкмана). Для выявления эшерихий.
Глюкозопептонная среда (Эйкмана) концентрированная. Для выявления эшерихий.
Среды Гисса с глюкозой, лактозой, сахарозой, маннитом, мальтозой Основной пестрый ряд для дифференциации бактерий
Флаконы, пробирки по 10 мл , наборы
Комплект для приготовления 200 мл среды
Комплект для приготовления 200 мл среды
Тетратионатовая среда. Селективная и дифференциально-диагностическая питательная среда для энтеробактерий (одна из основных в мировой практике)
Комплект для приготовления 200 мл среды
Среда Мак Конки плотная. Основная дифференциально-диагностическая и селективная среда для энтеробактерий в зарубежной микробиологии.
Молочно-ингибиторная среда. Для селективного выделения грамположительных кокков, в т.ч. энтерококков.
Комплект для приготовления 200 мл среды, чашки Петри 90 и 100 мм
Среда Мюллера. Для селективного выделения сальмонелл.
Комплект для приготовления 100 мл среды
Среда Мюллера-Кауфмана. Для селективного выделения сальмонелл.
Комплект для приготовления 2 00 мл среды
Бульон желчный 20%. Селективная среда для выделения сальмонелл.
Питательная среда для определения сальмонелл в смывах.
Среда Раппопорта-Василиадиса. Для выделения сальмонелл и иерсиний
Комплекты для приготовления 200 мл среды
Среда обогащения для энтеробактерий (ГРМ № 3)
ПИТАТЕЛЬНЫЕ СРЕДЫ ДЛЯ КУЛЬТИВИРОВАНИЯ НЕФЕРМЕНТИРУЮЩИХ ГРАМОТРИЦАТЕЛЬНЫХ БАКТЕРИЙ
Сред ы для культивирования Alcaligenes faecalis жидкая и плотная .
Среда для неферментирующих грамотрицательных бактерий плотная.
СРЕДЫ ДЛЯ ОБЛИГАТНО-АНАЭРОБНЫХ БАКТЕРИЙ
Мир облигатно анаэробных бактерий обширен. Он включает разнообразные по культурально-морфологическим свойствам микроорганизмы, в том числе такие важные и для гомеостаза человека, и с точки зрения этиологии многих его патологий, как бактероиды, эу-бактерии, бифидобактерии, превотеллы, фузобактерии, клостридии, анаэробные кокки и др. Это определяет многообразие питательных сред, используемых в микробиологии, в том числе медицинской. В последнем случае речь идет о культивировании микроорганизмов, требовательных к ростовым факторам. Как правило, питательные среды для облигатных анаэробов-возбудителей заболеваний человека, отличаются высоким содержанием разнообразных источников питания бактерий. Другой важный элемент этих сред - поддержание адекватного редокс-потенциала: среды должны быть восстановленными и длительно сохранять это свойство. Последнее достигается включением в состав сред «восстановителей», удалением кислорода прогреванием среды под вазелиновым маслом, заполнение флакона со средой инертными газами, герметичным укупориванием и т.д.
Традиционно в качестве универсальной «анаэробной» среды используется обогащенный тиогликолевый бульон, для культивирования патогенных клостридий - среда Китта-Тароцци, для бифидобактерии - среда Блаурокка. Наиболее богата источниками питания для облигатно-анаэробных бактерий плотная и жидкая среда Шедлера. Селекционирующие добавки позволяют ограничить или предупредить рост сопутствующей анаэробам микрофлоры.
Среда для бифидобактерий ( Блаурокка ) . Одна из основных сред по диагностике дисбактериоза.
Флаконы, пробирки 10, 30 мл
Среда Вильсона-Блера плотная. Для селективного выделения и дифференциации клостридий, а также сальмонелл.
Комплекты для приготовления 200 мл среды
С реда Шедлера. Жидкая и плотная для выделения облигатно-анаэробных бактерий.
ДРУГИЕ ПИТАТЕЛЬНЫЕ СРЕДЫ
Среда Мюллера-Хинтон. Плотная и жидкая для определения чувствительности микроорганизмов к антибиотикам
Среда АГВ Для определения чувствительности микроорганизмов к антибиотикам
Казеиново-угольный агар (КУА). Для выделения и культивирования бордетелл.
Среда для определения концентрации антибиотиков в биосубстратах.
Комплекты для приготовления 360 мл среды
Комплект для приготовления 300 мл среды, чашки Петри 40,90,100 мм
ТРАНСПОРТНЫЕ СРЕДЫ
Все образцы биосубстратов, взятые для посева, должны быть незамедлительно переданы в микробиологическую лабораторию для анализа. Однако, подобная практика не всегда реализуется. Одним из приемов, содействующих сохранению микрофлоры, причем, не только при отсрочке посева, но и сразу же при взятии биоматериала, является применение транспортных питательных сред (ТПС).
ТПС предупреждают гибель микробных клеток, сохраняют их жизнеспособность, а, следовательно, и способность к репликации после посева, но при этом препятствуют размножению. Для этого в рецептуру ТПС введены в том или ином сочетании вещества, обеспечивающие механическую защиту клеток, оптимальные показатели рН, редокс-потенциала, осмотические свойства сред. Некоторые ТПС создают анаэробные условия вегетации культур. Существуют ТПС с селективными свойствами.
ТПС могут использоваться как для сохранения микрофлоры биосубстратов, так и отдельных групп микроорганизмов. Среди последних особо выделяют кампилобактеры, шигеллы, бордетеллы, сальмонеллы, иерсинии, коринебактерии, облигатно-анаэробные бактерии, среди биосубстратов - мазки из цервикального канала, наружного уха, слизистой носа, конъюнктивы, гортани, биоптаты обсемененных тканей и костного мозга.
ПИТАТЕЛЬНЫЕ СРЕДЫ ДЛЯ ВЫДЕЛЕНИЯ И КУЛЬТИВИРОВАНИЯ ГРИБОВ
Бульон Сабуро. Для культивирования грибов , в т . ч . дерматофитов .
Агар Сабуро. Для культивирования грибов , в т . ч . дерматофитов .
Флаконы , чашки Петри
Агар Сабуро с 3% и 5% хлорида натрия и селек ционирующей добавкой. Селективная среда для выделения грибов при смешанной микрофлоре.
Комплекты для приготовления 200 мл среды
Агар Сабуро с мальтозой д ля культивирования и хранения грибов , утилизирующих данный углевод.
Агар Сабуро в модификации Эммонса. Для культивирования Sporothrix spp ., Trichophyton spp .
Сред ы Чапека. Жидкая и плотная д ля культивирования сапрофитных грибов , в т . ч . Aspergillus и Penicillium .
Агар Чапека с пептоном для широкого круга грибов .
Агар Чапека с дрожжевым экстрактом для культивирования Aspergillus niger
Агар Чапека с 17% сахарозы для культиви рования Aspergillus spp .
Среда Чапека - Докса жидкая. Для широкого круга грибов , утилизирующих нитраты.
Сусло - агар для культивирования грибов с содержанием агара 0,5, 1,2, 2%
Флаконы , чашки Петри
ПИТАТЕЛЬНЫЕ СРЕДЫ ДЛЯ ВЫДЕЛЕНИЯ И КУЛЬТИВИРОВАНИЯ МОЛОЧНОКИСЛЫХ БАКТЕРИЙ
Лактобактерии (Lactobacillus spp.) принадлежат к группе неспорообразующих грамположительных палочек. Они являются представителями резидентной микрофлоры человека, в первую очередь полости рта, кишечника и влагалища. Изменение количественного и качественного состава лактобактерий является диагностическим признаком дисбактериоза. В редких случаях лактобактерий могут явиться возбудителями инфекционной патологии, чаще у новорожденных: сепсис, эндокардит, менингит, пневмония и некоторые другие. Большое значение эти микроорганизмы имеют для пищевой промышленности, поскольку занимают ключевую позицию в производстве молочнокислых продуктов (простокваша, кефир, йогурт, ацидофилин). Таким образом, перед микробиологами стоят непростые задачи выделения, идентификации, культивирования и хранения Lactobacillus spp. Микроорганизм полиморфен (палочки, коккобациллы), разнообразен по типу дыхания (факультативный анаэроб, микроаэрофил, облигатный анаэроб). Он обладает немногочисленными культуральными признаками, позволяющими отличать его от морфологически сходных бактерий (образование молочной кислоты, отсутствие каталазы, устойчивость к ванкомицину и некоторые другие.). Важное место в выделении лактобактерий занимают питательные среды, обеспечивающие рост и , в определенной степени, селекцию этих микроорганизмов. В мировой микробиологической практике их насчитывают несколько десятков. Наибольшее признание получила среда de Man, Rogosa, Sharpe, которую по первым буквам фамилий авторов обычно обозначают как среда MRS (MPC в русской транскрипции). Существует ряд модификаций этой среды, улучшающих, по мнению разработчиков, их ростовые свойства и селективность. В России получила распространение среда МРС-4, которая заметно отличается от авторской по своей рецептуре, но признана достаточно эффективной. Среда МРС-2 (полужидкая) является одной из лучших при работе с чистой культурой и для хранения культур. Лактобациллы дают в столбике среды типичный рост.
Среда МРС авторская плотная. Среда de Man , Rogosa , Sharpe ( MRS ) плотная для культивирования молочнокислых бактерий.
Среда МРС авторская жидкая. Среда de Man , Rogosa , Sharpe ( MRS ) плотная для культивирования молочнокислых бактерий.
Среда МРС модифицированная плотная. Включен Твин 80, рН 6,2. Для выделения и культивирования Lacto - bacillus spp .
Среда МРС модифицированная жидкая . Включен Твин 80, рН 6,2. Для выделения и культивирования Lacto - bacillus spp .
Среда МРС жидкая ( вариант LHSB ), рН 4,3. Для выделения лактобактерий из продуктов питания.
Среда МРС плотная ( вариант LHSB ), рН 5,5. Для выделения лактобактерий из продуктов питания.
Среда Элликера плотная и жидкая для молочнокисло го стрептококка.
ПИТАТЕЛЬНЫЕ СРЕДЫ ДЛЯ ЛИСТЕРИЙ (ПО ГОСТ Р 51921-2ОО2 Г.)
Триптон - соевый бульон. *
Флаконы по 200 и 400 мл
Триптон - соевый агар. *
Флаконы по 200 и 400 мл
Триптиказо - соевый бульон. *
Флаконы по 200 и 400 мл
Триптиказо - соевый агар. *
Флаконы по 200 и 400 мл
СЕЛЕКТИВНЫЕ СРЕДЫ ОБОГАЩЕНИЯ ДЛЯ ЛИСТЕРИЙ
Питательныe бульон ы ПБЛ -1 и ПБЛ -2.
Селективная добавка к ПБЛ -1 и ПБЛ -2.
Флаконы по 225 мл
Селективн ые добавк и к бульону Фразера " полуконцентрированному " и " концентрированному ".
СРЕДЫ СЕЛЕКТИВНО-ДИАГНОСТИЧЕСКИЕ ДЛЯ ЛИСТЕРИЙ
Селективная добавка к агару ПАЛ .
Набор на 1 л среды
Селективная добавка к Оксфордскому ага ру с циклогексимидом.
На 500 мл среды
Селективная добавка к Оксфордскому агару без циклогексимида.
Набор на 1 л среды
Селективная добавка к ПАЛКАМ - агару.
Набор на 1 л среды
Полужидкая среда для определения по движности листерий.
На 5 определений
На 5 определений
СРЕДЫ ДЛЯ ВЫДЕЛЕНИЯ ГЕМОКУЛЬТУР

Уважаемые коллеги!
17.05.2018 г. в связи с плановым отключением электроэнергии на весь день, в нашей организации объявляется выходной день.
Описание патента на изобретение RU2175671C1
Изобретение относится к медицине, а именно к клинической микробиологии, и может быть использовано при бактериологическом исследовании крови на гемокультуру.
Метод получения гемокультуры является наиболее ранним и надежным методом бактериологической диагностики сальмонелл брюшного тифа и паратифов.
Известны среды для выделения гемокультуры сальмонелл: желчный бульон, бульон с 1% глюкозой, стерильная дистиллированная вода (1). Недостатком желчного бульона является то, что он не позволяет дифференцировать сальмонеллы по признаку газо- и кислотообразования, так как в его составе отсутствует индикатор и углевод. Глюкозный бульон обладает низким накопительным эффектом, так как не подавляет бактерицидные свойства крови. Дистиллированная вода не обладает накопительным эффектом ввиду отсутствия питательных веществ, ей присущи также и все другие указанные выше недостатки.
Наиболее близким решением задачи того же назначения по совокупности признаков и достигаемому эффекту является среда Рапопорт, предназначенная для выделения и накопления гемокультуры сальмонелл (4). Среда содержит в качестве источника азота бульон мясопептонный или Хоттингера, в качестве источника углерода - глюкозу, в качестве компонента, препятствующего свертыванию крови и подавляющего ее бактерицидное действие, - желчь, в качестве индикатора кислотообразования - индикатор Андреде.
К причинам, препятствующим достижению указанного ниже технического результата при использовании известной среды, принятой за прототип, являются слабые накопительные и дифференцирующие свойства среды, что вызывает необходимость инкубации посевов в течение 6-10 суток (2, 3). По этой причине удлиняются сроки постановки диагноза.
Задача предлагаемого изобретения - повышение накопительных и дифференцирующих свойств среды.
Указанный технический результат при осуществлении изобретения достигается тем, что предлагаемая среда дополнительно содержит агар и натрий углекислый, в качестве источника азота содержит питательный бульон из рыбы, в качестве источника углерода - маннит, в качестве индикатора кислотообразования - феноловый красный при следующем соотношении компонентов, г/л:
Питательный бульон из рыбы - 10 - 20
Желчь бычья - 10 - 20
Маннит - 10 -20
Агар - 1,0 - 2,0
Феноловый красный - 0,03 - 0,05
Натрий углекислый - 0,2 - 0,4
Вода дистиллированная - До 1 л
Внесение в среду дополнительного агара, обладающего высокой сорбционной способностью, нейтрализует продукты метаболизма бактерий и предохраняет клетки от их токсического действия, а высокая питательность рыбного бульона способствует повышению накопительных свойств среды.
Введение в предлагаемую среду маннита вместо глюкозы и дополнительно натрия углекислого обеспечивает более интенсивное образование бактериями газа, а агар способствует удерживанию пузырьков газа на поверхности и в толще среды, что позволяет провести четкую дифференциацию паратифозных бактерий, продуцирующих газ, от тифозных, не обладающих этим признаком.
Использование в среде индикатора фенолового красного, обладающего высокой чувствительностью к изменению pH среды, происходящего в результате сбраживания маннита сальмонеллами, позволяет провести визуальную оценку изменения цветной реакции среды.
Среду получают следующим образом.
Пример 1. В 0,5 л дистиллированной воды последовательно растворяют 10 г питательного бульона из рыбы (ФС 3505-98), 10 г сухой бычьей желчи, 10 г маннита, 1 г агара, 0,2 г натрия углекислого, 0,03 г фенолового красного, объем смеси доводят дистиллированной водой до 1 л воды. Смесь нагревают до полного расплавления агара, разливают во флаконы (по 100 мл) и стерилизуют при 115 o C в течение 20 мин. Контроль качества среды осуществляют путем посева во флаконы тест-штаммов S.typhi Н901, S.paratyphi А и В из разведения 10 -6 (100 клеток). После инкубации посевов в термостате при 37 o C в течение 18-24 ч отмечают наличие роста (помутнение среды), а также, газо- и кислотообразование. Одновременно осуществляют высев из каждого флакона по 0,1 мл взвеси на чашки с питательным агаром. Через 18-24 ч инкубации посевов в термостате при 37 o C осуществляют подсчет сформировавшихся колоний и определяют количество микробных клеток в 1 мл среды (накопительный эффект).
Качество среды оценивают также визуально по наличию газа и по изменению цвета среды.
Пример 2. Отличается от примера 1 тем, что в 0,5 л дистиллированной воды последовательно растворяют 15 г питательного бульона из рыбы, 15 г сухой желчи, 15 г маннита, 1,5 г агара, 0,3 г натрия углекислого, 0,04 г индикатора фенолового красного, объем смеси доводят дистиллированной водой до 1 л. Далее согласно примеру 1.
Пример 3. Отличается от примера 1,2 тем, что в 0,5 л дистиллированной воды последовательно растворяют 20 г питательного бульона из рыбы, 20 г сухой желчи, 20 г маннита, 2,0 г агара, 0,4 г натрия углекислого, 0,05 г индикатора фенолового красного, объем смеси доводят дистиллированной водой до 1 л. Далее согласно примеру 1.
Результаты бактериологического контроля предлагаемой и известной сред представлены в таблице.
Данные таблицы свидетельствуют о заметном превосходстве предлагаемой среды перед известной. Так, накопительный эффект предлагаемой среды более чем 100 раз превосходит известную среду, что делает возможным выявление сальмонелл при меньшем их исходном количестве в исследованном материале (крови).
Дифференцирующие свойства по признаку газообразования более выражены на предлагаемой среде.
Указанные преимущества предлагаемой среды повышают эффективность диагностики тифо-паратифозной инфекции при исследовании крови на гемокультуру.
Источники информации
1. Справочник по микробиологическим и вирусологическим методам исследования. Под ред. М.О. Биргера. М.: Медицина, 1982, стр. 5.
2. Ф. К. Черкес, Л.Б. Богоявленская, Н.А. Бельская. Микробиология. М.: Медицина, 1986, стр. 286.
3. Энтеробактерии. Руководство. Под ред. В.И. Покровского. М.: Медицина, 1985, стр. 31.
4. Там же, стр. 262 (прототип).
Похожие патенты RU2175671C1
Иллюстрации к изобретению RU 2 175 671 C1

Реферат патента 2001 года ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ ВЫДЕЛЕНИЯ ГЕМОКУЛЬТУРЫ ПРИ ДИАГНОСТИКЕ БРЮШНОГО ТИФА И ПАРАТИФОВ
Изобретение относится к медицине, может быть использовано при бактериологическом исследовании крови на гемокультуру сальмонелл. Среда содержит агар и натрий углекислый, желчь бычью, питательный бульон из рыбы, маннит, феноловый красный. Среда обладает высоким накопительным эффектом и обеспечивает четкую дифференциацию паратифозных бактерий от тифозных по признаку газообразования. 1 табл.
Формула изобретения RU 2 175 671 C1
Питательная среда для выделения гемокультуры сальмонелл брюшного тифа и паратифов, содержащая источник азота, источник углерода, желчь бычью, индикатор, дистиллированную воду, отличающаяся тем, что она дополнительно содержит агар и натрий углекислый, в качестве источника азота содержит питательный бульон из рыбы, в качестве источника углерода - маннит, в качестве индикатора кислотообразования - феноловый красный при следующем соотношении компонентов, г/л:
Питательный бульон из рыбы - 10 - 20
Желчь бычья - 10 - 20
Маннит - 10 - 20
Агар - 1,0 - 2,0
Феноловый красный - 0,03 - 0,05
Натрий углекислый - 0,2 - 0,4
Вода дистиллированная - До 1 л
61. Патогенные сальмонеллы (возбудители сальмонеллеза брюшного тифа и паратифов А, В): систематика, морфология, культуральные и тинкториальные свойства, биохимические особенности, антигенная структура и токсинообразование, патогенез и клиника. Микробиологическая диагностика. Профилактика и лечение.
Сальмонеллы - большая группа энтеробактерий, среди которых различные серотипы - возбудители брюшного тифа, паратифов А, В и С и наиболее распространенных пищевых токсикоинфекций - сальмонеллезов. По признаку патогенности для человека сальмонеллы разделяют на патогенные для человека- антропонозы (вызывают брюшной тиф и паратифы А и В) и патогенные для человека и животных - зоонозы (вызывают сальмонеллезы). Несмотря на значительные различия сальмонелл по антигенным характеристикам, биохимическим свойствам, вызываемым ими заболеваниям, по современной, но недостаточно удобной и совершенной классификации выделяют два вида - S.bongori и S.enteritica. Последний разделен на подвиды, из которых наибольшее значение имеют подвиды choleraesuis и salamae. Подвид choleraesuis включает наибольшую часть известных сероваров сальмонелл (около 1400 из примерно 2400).
Морфология. Прямые грамотрицательные палочки размером 2-4 x 0,5 мкм. Подвижны благодаря наличию перитрихиально расположенных жгутиков.
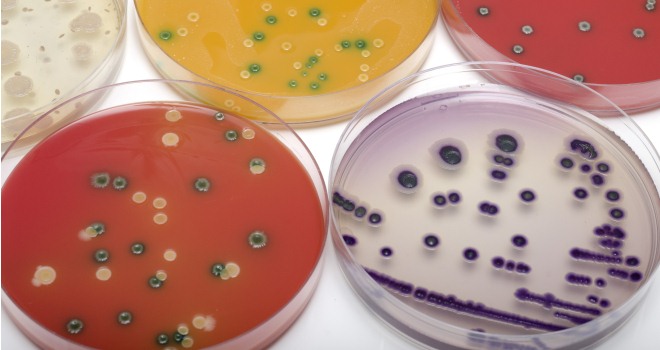
Культуральные и биохимические свойства. Факультативные анаэробы, хорошо растут на простых питательных средах. Оптимум рН- 7,2-7,4, температуры - +37. Метаболизм - окислительный и бродильный. Сальмонеллы ферментируют глюкозу и другие углеводы с образованием кислоты и газа (серотип Salmonella typhi газообразования не вызывает). Обычно не ферментируют лактозу (на средах с этим углеводом - безцветные колонии), сахарозу. Оксидаза- отрицательны, каталаза - положительны. Реакция Фогеса - Проскауэра отрицательна.
На основании биохимических (ферментативных) свойств сальмонеллы разделены на четыре группы. Характерные признаки сальмонелл - образование сероводорода, отсутствие продукции индола и аэробность. Для выделения используют дифференциально - диагностические среды (висмут - сульфит агар, среды Эндо, Плоскирева, SS агар) и среды обогащения (селенитовый бульон, желчный бульон, среда Раппопорта). S- формы образуют мелкие (от 1 до 4 мм) прозрачные колонии (на среде Эндо - розоватые, на среде Плоскирева - безцветные, на висмут - сульфит агаре - черные, с металлическим блеском). На жидких средах S- формы дают равномерное помутнение, R- формы - осадок.
Антигенная структура. Выделяют О-, Н- и К- антигены. К группе К- антигенов относят Vi- антигены (антигены вирулентности). Благодаря более поверхностному расположению (чем О- антигены) Vi- антиген может препятствовать агглютинации культур сальмонелл О- специфической сывороткой (экранирование). Для дифференциации сальмонелл применяют схему (серологическую классификацию) Кауфманна - Уайта.
В соответствии со структурой О- антигенов сальмонеллы подразделяют на О- группы (67 серогрупп), в каждую из которых входят серологические типы, отличающиеся строением Н- антигенов. Принадлежность сальмонелл к определенному серовару устанавливают при изучении антигенной структуры в соответствии со схемой Кауфманна - Уайта. Примеры: серотип S.paratyphi A относится к серогруппе А, S.paratyphi В - к серогруппе В, S.paratyphi С - к группе С, S.typhi - к серогруппе D.
1.Факторы адгезии и колонизации.
2. Способность к внутриклеточному паразитированию, препятствовать фагоцитозу, размножаться в клетках лимфоидной ткани выражены у возбудителей брюшного тифа, паратифов А и В, способствуя хроническому носительству.
4. Термолабильные и термостабильные энтеротоксины.
6. Существенное значение имеют плазмиды вирулентности и R- плазмиды.
7. Vi - антиген ингибирует действие сывороточных и фагоцитарных бактериоцидных факторов.
Основными факторами патогенности сальмонелл является их способность проникать в макрофаги и размножаться в лимфоидных образованиях собственно слизистого слоя тонкого кишечника (пейеровы бляшки, солитарные фолликулы), а также продукция эндотоксина.
Патогенез поражений. Различия клинических форм заболеваний, вызываемых сальмонеллами, зависит от вирулентности и дозы возбудителя и состояния иммунной системы организма. Обычная доза, вызывающая клинические проявления - 106 - 109 бактерий, меньшая доза достаточна при иммунодефицитах, гипохлоргидрии и других заболеваниях желудочно - кишечного тракта.
Выделяют следующие основные формы сальмонеллезной инфекции:
- генерализованную (тифоподобный и септикопиемический варианты);
- бактерионосительство (острое, хроническое, транзиторное).
Существенные патогенетические особенности инфекционного процесса, вызываемого серотипами S.typhi, S.paratyphi A,B, являются основанием для выделения тифо- паратифозных заболеваний в самостоятельную нозологическую группу. Каждой фазе патогенеза соответствует клинический период заболевания и своя тактика лабораторного обследования. Основные фазы - внедрения возбудителя (соответствует инкубационному периоду), первичной локализации возбудителя (продромальный период), бактеремии (первая неделя заболевания), вторичной локализации сальмонелл (разгар заболевания - 2-3 недели), выделительно- аллергическая (реконвалесценция - 4 неделя заболевания).
Проникшие через рот сальмонеллы попадают в эпителиальные клетки двенадцатиперсной и тонкой кишки посредством эндоцитоза. Они легко проникают в эпителиальные клетки, но не размножаются здесь, а проходят и размножаются в лимфатическом аппарате тонкого кишечника. Сальмонеллы размножаются преимущественно в lamina propria (первичная локализация), что сопровождается местной воспалительной реакцией слизистой оболочки, притоком жидкости в очаг поражения и развитием диарейного синдрома (гастроэнтерит). Энтеротоксины повышают уровень циклического аденомонофосфата (цАМФ), происходит повышение уровня гистамина и других биологически активных веществ, проницаемости сосудов. Наблюдаются водно - электролитные нарушения, развиваются гипоксия и ацидоз, которые усугубляют патологический процесс с преобладанием сосудистых растройств. Происходит разрушение части сальмонелл с выделением эндотоксина, сенсибилизация (ГЗТ) лимфатического аппарата тонкого кишечника.
Из слизистой оболочки сальмонеллы могут попадать в лимфо- и далее в кровоток, вызывая бактеремию. В большинстве случаев она носит транзиторный характер, т.к. сальмонеллы элиминируются фагоцитами.
В отличие от других сальмонелл, возбудители брюшного тифа и паратифов, проникнув в кровоток, способны выживать и размножаться в фагоцитах. Они могут размножаться в мезентериальных лимфоузлах, печени и селезенке и вызывать генерализацию процесса. После гибели фагоцитов сальмонеллы вновь поступают в кровь. При этом Vi- антиген ингибирует бактерицидные факторы.
При гибели сальмонелл освобождается эндотоксин, угнетающий деятельность центральной нервной системы (тиф - от греч. typhos - туман, спутанное сознание) и вызывающий длительную лихорадку. Действие эндотоксина может вызвать миокардит, миокардиодистрофию, инфекционно - токсический шок.
В результате бактеремии происходит генерализованное инфицирование желчного пузыря, почек, печени, костного мозга, твердых мозговых оболочек (вторичная локализация сальмонелл). Происходит вторичная инвазия эпителия кишечника, особенно пейеровых бляшек. В сенсибилизированной сальмонеллами стенке развивается аллергическое воспаление с образованием основного грозного осложнения - брюшнотифозных язв. Наблюдается длительное носительство сальмонелл в желчном пузыре с выделением возбудителя с испражнениями, пиелонефриты, кровотечения и перфорации кишечника при поражении пейеровых бляшек. Затем происходит формирование постинфекционного иммунитета, элиминация возбудителя и заживление язв или формирование бактерионосительства (в Западной Сибири часто на фоне хронического описторхоза).
Возбудителями сальмонеллезов являются другие серотипы сальмонелл, патогенные для человека и животных (S.typhimurium, S.enteritidis, S.heldelberg, S. newport и другие). В основе патогенеза сальмонеллезов - действие самого возбудителя (его взаимодействия с организмом хозяина) и эндотоксина, накапливающегося в пищевых продуктах, инфицированных сальмонеллами. В классическом варианте сальмонеллезная токсикоинфекция - гастроэнтерит. Однако при прорыве лимфатического барьера кишечника могут развиваться генерализованные и внекишечные формы сальмонеллезов (менингит, плеврит, эндокардит, артрит, абсцессы печени и селезенки, пиелонефрит и др.). Увеличение генерализованных и внекишечных форм сальмонеллезов связано с увеличением количества иммунодефицитных состояний, что имеет особое значение при ВИЧ- инфекции.
Отдельную проблему представляют госпитальные штаммы сальмонелл (чаще отдельные фаговары S.typhimurium), вызывающие вспышки внутрибольничных инфекций преимущественно среди новорожденных и ослабленных детей. Они передаются преимущественно контактно- бытовым путем от больных детей и бактерионосителей, обладают высокой инвазивной активностью, часто вызывая бактеремию и сепсис. Эпидемические штаммы характеризуются множественной лекарственной устойчивостью (R- плазмиды), высокой резистентностью, в том числе к действию высоких температур.
Эпидемиологические особенности. Характерно повсеместное распространение. Основные резервуары сальмонелл - человек (возбудители брюшного тифа и паратифа А) и различные животные (остальные серотипы сальмонелл). Основные возбудители отличаются полипатогенностью. Основные источники заражения - мясные и молочные продукты, яйца, птице- и рыбопродукты. Основные пути передачи - пищевой и водный, реже - контактный. Характерна чрезвычайная множественность резервуаров и возможных источников инфекции. Основное значение имеют сельскохозяйственные животные и птицы.
Лабораторная диагностика. Основной метод - бактериологический. Исходя из патогенеза оптимальными сроками бактериологических исследований при гастроинтестинальных формах являются первые дни, при генерализованных формах - конец второй - начало третьей недели заболевания. При исследовании различных материалов (испражнения, кровь, моча, желчь, рвотные массы, пищевые остатки) наибольшая частота положительных результатов отмечается при исследовании испражнений, для возбудителя брюшного тифа и паратифов - крови (гемокультура).
Исследования проводят по стандартной схеме. Исследуемый материал засевают на плотные дифференциально - диагностические среды - высокоселективные (висмут- сульфит агар, агар с бриллиантовым зеленым), среднеселективные (среда Плоскирева, слабощелочной агар), низкоселективные (агары Эндо и Левина) и в среды обогащения. Для посева крови используют среду Рапопорт. На висмут- сульфит агаре колонии сальмонелл приобретают черный (реже- зеленоватый) цвет.Выросшие колонии пересевают на среды для первичной (среды Ресселя) и биохимической (сероводород, мочевина, глюкоза, лактоза) идентификации. Для предварительной идентификации используют О1- сальмонеллезный фаг, к которому чувствительно до 98% сальмонелл.
Для идентификации культур в РА используют поливалентные и моновалентные О-, Н- и Vi- антисыворотки. Сначала используют поливалентные адсорбированные О- и Н- сыворотки, а затем- соответствующие моновалентные О- и Н- сыворотки. Для идентификации возбудителей брюшного тифа и паратифов используют антитела к антигену О2 (S.paratyphi A), O4 (S.paratyphi B), O9 (S.typhi). Если культура не агглютинируется О- сывороткой, ее нужно исследовать с Vi- сывороткой. Для быстрого выявления сальмонелл используют поливалентные люминесцентные сыворотки.
Серологические исследования проводят для диагностики, а также выявления и дифференциации различных форм носительства. Применяют РА (реакцию Видаля) с О- и Н- диагностикумами и РПГА с применением поливалентных эритроцитарных диагностикумов, содержащих полисахаридные антигены серогрупп А,В,С,Д и Е и Vi- антиген.
Лечение - антибиотики (левомицетин и др.). Часто выявляют резистентные к антибиотикам штаммы. Необходимо определять антибиотикорезистентность выделенных культур.
Специфическая профилактика может применяться преимущественно в отношении брюшного тифа. Применяют химическую сорбированную брюшнотифозную моновакцину. Вакцинацию в настоящее время применяют преимущественно по эпидемическим показаниям.
Кат. № M1255-500G

Цена: по запросу
Вы можете добавить товар в корзину, указав количество
Производитель: HiMedia Laboratories
Страна: Индия
Ед. изм.: упаковка
Упаковка: 500г
Вид упаковки: полиэтиленовая банка
Артикул: M1255-500G
Бульон с тетратионатом, бриллиантовым зеленым и желчью используют для выделения и идентификации сальмонелл
Функциональное назначение
Сальмонеллы - грамотрицательные анаэробные неспорообразующие неподвижные палочки в семействе энтеробактерий. Они широко распространены в желудочно-кишечном тракте животных. Их сложно отличить от кишечной палочки биохимическими методами.
Состав тетратионатного бульона предложен Mueller, затем модифицирован Kauffman. Тетратионатный бульон с бриллиантовым зеленым используют в качестве среды обогащения для сальмонелл, применяемый для восстановления поврежденных клеток культур и увеличения их численности. Используют для выделения и идентификации сальмонелл из пищевых продуктов, воды и других материалов в ходе санитарно-микробиологического исследования.
Пептический перевар животной ткани обеспечивает присутствие соединений азота и углерода, микроэлементов, витаминов и других факторов для роста сальмонелл. Бриллиантовый зеленый и Ox bile (препарат из бычьей желчи) подавляют рост грамотрицательных и грамположительных микроорганизмов. Тетратионат калия подавляет рост нормальной фекальной микрофлоры. Хлорид натрия обеспечивает оптимальное осмотическое давление. После инкубирования в бульоне материал наносят штрихами на дифференциальные среды для выделения и идентификации. Среда не подходит для роста Salmonella typhi и Salmonella paratyphi
Технические характеристики
Состав, грамм/литр):
Пептический перевар животной ткани 8,60;
Ox bile (препарат из бычьей желчи) 8,00;
Натрия хлорид 6,40;
Кальция карбонат 20,00;
Калия тетратионат 20,00;
Бриллиантовый зеленый 0,07.
Конечное значение рН (при 25ºС) 7,0 ± 0,2.
Гомогенный сыпучий порошок бежевого цвета. Готовая среда голубовато-зеленого цвета, опалесцирует, с белым осадком.
Форма выпуска: непрозрачные водоотталкивающие пластиковые флаконы с навинчивающимся колпачком, который имеет внутреннюю крышку, не требующие дополнительного укупоривания.
Порошок хранить при температуре ниже +30°С, плотно закрытым. Использовать до даты, указанной на этикетке. Готовую среду хранить при температуре +2…8°С.
Зарегистрировано в Росздравнадзор
Документация и инструкции

инструкция по применению (15.61 KB)
 |  |  |
Becton Dickinson предлагает среды высокого качества на основании более чем 180-летнего совместного опыта компаний Difco и BBL. Среды BD обеспечивают повторяемость высокого качества от лота к лоту, что гарантирует воспроизводимость результатов. Это самое ценное в продукции BD и самое сложное при производстве сред из сырья природного происхождения.
Питательные среды для культивирования широкого круга микроорганизмов с целью их выявления в пищевой промышленности, ветеринарной, кондитерской, хлебопекарной, фармацевтической и косметической отраслях:
- среды для выращивания широкого спектра м/о;
- селективные среды для выделения конкретного возбудителя;
- дифференциальные среды, позволяющие различать отдельные виды м/о;
- накопительные среды для обогащения конкретного вида м/о.
Специальные питательные среды – среды, на которых создаются условия для выращивания тех бактерий, которые не растут на простых средах. Кровяной агар или кровяной бульон – получают путем добавления к питательной среде 5-10% подогретой стерильной дефибринированной крови барана, кролика лошади, человека. Среда используется для выделения стрептококков, пневмококков и других бактерий, а также для изучения гемолитической активности. Сывороточный бульон или сывороточный агар получают, путем добавления к простым средам 15-20% лошадиной или бычьей сыворотки. Среда применяется для выделения пневмококков, менингококков. Желчный бульон или желчный агар получают путем добавления к питательной среде медицинской желчи без консерванта, или свежеполученной от крупного рогатого скота. Среда применяется для выделения брюшнотифозных, паратифозных и дизентерийных палочек. Специальные среды для культивирования анаэробных бактерий: среда Китта-Тароцци состоит из питательного бульона, глюкозы и кусочков печени или мясного фаршадля адсорбции кислорода.
Желатин – животный белок, продукт частичного гидролиза коллагена. Имеет вид бесцветных или светло-желтых пластинок без запаха и вкуса. В холодной воде набухает, сильно поглощая воду. При температуре 30°С растворяется, при охлаждении до 20-22°С превращается в гель (студень). Используется в микробиологии для изучения протеолитических ферментов.
Дифференциально-диагностические среды позволяют различить один вид микроба от другого. Принцип построения дифференциально-диагностических сред основан на разной биохимической активности бактерий. В состав дифференциально-диагностических сред входит основная питательная среда, обеспечивающая размножение бактерий, определенный химический субстрат, различное отношение к которому является диагностическим признаком, индикатор, изменение цвета которого свидетельствует о разложении субстрата и образовании кислых продуктов.
Агар Эндо – плотная среда, применяется для выделения и первичной идентификации энтеробактерий. В состав ее входят, кроме питательной основы, лактоза и основной фуксин, обесцвеченный сульфитом и фосфатом натрия. Правильно приготовленная среда бесцветна или имеет слегка розовый оттенок. Колонии бактерий (кишечная палочка), ферментирующие лактозу, окрашиваются на ней в красный цвет; бактерии, не ферментирующие лактозу (сальмонеллы), остаются бесцветными.
Среда Левина (лактозоэозинметиленовый агар) – среда для выделения энтеробактерий. Колонии лактозоферментирующих бактерий окрашены в темно-синий или черный цвет, колонии лактозоотрицательных бактерий вырастают под цвет среды (светло-фиолетового цвета).
Среды Гисса – набор определенных углеводов для изучения ферментативной активности бактерий и их дифференциации по этим признакам.
Элективные питательные среды содержат дополнительные вещества, задерживающие рост грамположительных бактерий. Селективные питательные среды стимулируют рост одних микробов и угнетают рост других. Селективные условия получают путем добавления в среду химических веществ. Так как в этих средах патогенные бактерии размножаются и накапливаются, их называют также средами обогащения.
Среда Плоскирева – плотная питательная среда, содержащая соли желчных кислот, бриллиантовый зеленый, лактозу и индикатор. Эта среда является не только селективной, так как подавляет рост многих микробов и способствует лучшему росту возбудителей брюшного тифа, паратифов, дизентерии, но и дифференциально-диагностической, так как лактозоотрицательные бактерии (шигеллы) образуют на ней бесцветные колонии, а лактозоположительные – кирпично-красные.
Селенитовая среда - является лучшей средой обогащена для сальмонелл и дизентерийных микробов Зонне. Селенит натрии, содержащийся в среде, стимулирует рост этих бактерий и подавляет рост сопутствующей флоры.
Среда Мюллера служит для накопления сальмонелл. К питательной среде добавлют мел, раствор Люголя и гипосульфит натрия. При взаимодействии этих веществ образуется тетратионат натрия, который угнетает рост кишечных палочек, но создает благоприятные условия для размножения сальмонелл.
Висмут-сульфит агар (среда Вильсона-Блера) – содержит соли висмута, бриллиантовую зелень. Сальмонеллы растут на этой среде в виде колоний чернота цвета. Другие виды бактерий на этой среде роста не дают.
Желточно-солевой агар (ЖСА) – среда для выделения стафилококков, содержит до 10% хлорида натрия, что подавляет большинство бактерий, содержащихся в материале. Кроме того, эта среда является и дифференциально-диагностической, так как присутствие яичного желтка позволяет выявить фермент лецитиназу (лецитовителлазу), который образуют патогенные стафилококки. Лецитиназа расщепляет лецитин на фосфорхолины и нерастворимые в воде жирные кислоты, поэтому среда вокруг лецитиназоположительных колоний мутнеет и появляется опалесцирующая зона в виде «радужного венчика».
Теллуритовые среды (сывороточно-теллуритовый агар, кровяно-теллуритовый агар) – селективные среды для выделения дифтерийных бактерий, содержат теллурит калия. Бесцветная соль теллура, содержащаяся в питательной среде, восстанавливается дифтерийными бактериями до металла, окрашивающего колонии в черный цвет.
Щелочной агар элективен для холерных вибрионов, щелочная реакция среды (рН 9,0) не препятствует росту холерных вибрионов, но тормозит рост других микроорганизмов.
Консервирующие среды – среды, содержат добавки, предупреждающие размножение и гибель микробов, что способствует сохранению их жизнеспособности. Консервирующие среды применяются когда нет возможности быстрого посева на питательные среды. Для бактерий наиболее употребительны консерванты:
а) глицериновая смесь, состоящая из 0,5 л химически чистого
глицерина и 1,0 л физиологического раствора.
б) боратная смесь
в) фосфатно-буферная смесь
Для длительного сохранения свежевыделенных и производственных культур применяют полужидкий голодный агар, в этой среде при пониженной жизнедеятельности микробов продукты обмена накапливаются незначительно, что способствует хорошему сохранению культур.
- АлтГТУ 419
- АлтГУ 113
- АмПГУ 296
- АГТУ 267
- БИТТУ 794
- БГТУ «Военмех» 1191
- БГМУ 172
- БГТУ 603
- БГУ 155
- БГУИР 391
- БелГУТ 4908
- БГЭУ 963
- БНТУ 1070
- БТЭУ ПК 689
- БрГУ 179
- ВНТУ 120
- ВГУЭС 426
- ВлГУ 645
- ВМедА 611
- ВолгГТУ 235
- ВНУ им. Даля 166
- ВЗФЭИ 245
- ВятГСХА 101
- ВятГГУ 139
- ВятГУ 559
- ГГДСК 171
- ГомГМК 501
- ГГМУ 1966
- ГГТУ им. Сухого 4467
- ГГУ им. Скорины 1590
- ГМА им. Макарова 299
- ДГПУ 159
- ДальГАУ 279
- ДВГГУ 134
- ДВГМУ 408
- ДВГТУ 936
- ДВГУПС 305
- ДВФУ 949
- ДонГТУ 498
- ДИТМ МНТУ 109
- ИвГМА 488
- ИГХТУ 131
- ИжГТУ 145
- КемГППК 171
- КемГУ 508
- КГМТУ 270
- КировАТ 147
- КГКСЭП 407
- КГТА им. Дегтярева 174
- КнАГТУ 2910
- КрасГАУ 345
- КрасГМУ 629
- КГПУ им. Астафьева 133
- КГТУ (СФУ) 567
- КГТЭИ (СФУ) 112
- КПК №2 177
- КубГТУ 138
- КубГУ 109
- КузГПА 182
- КузГТУ 789
- МГТУ им. Носова 369
- МГЭУ им. Сахарова 232
- МГЭК 249
- МГПУ 165
- МАИ 144
- МАДИ 151
- МГИУ 1179
- МГОУ 121
- МГСУ 331
- МГУ 273
- МГУКИ 101
- МГУПИ 225
- МГУПС (МИИТ) 637
- МГУТУ 122
- МТУСИ 179
- ХАИ 656
- ТПУ 455
- НИУ МЭИ 640
- НМСУ «Горный» 1701
- ХПИ 1534
- НТУУ «КПИ» 213
- НУК им. Макарова 543
- НВ 1001
- НГАВТ 362
- НГАУ 411
- НГАСУ 817
- НГМУ 665
- НГПУ 214
- НГТУ 4610
- НГУ 1993
- НГУЭУ 499
- НИИ 201
- ОмГТУ 302
- ОмГУПС 230
- СПбПК №4 115
- ПГУПС 2489
- ПГПУ им. Короленко 296
- ПНТУ им. Кондратюка 120
- РАНХиГС 190
- РОАТ МИИТ 608
- РТА 245
- РГГМУ 117
- РГПУ им. Герцена 123
- РГППУ 142
- РГСУ 162
- «МАТИ» — РГТУ 121
- РГУНиГ 260
- РЭУ им. Плеханова 123
- РГАТУ им. Соловьёва 219
- РязГМУ 125
- РГРТУ 666
- СамГТУ 131
- СПбГАСУ 315
- ИНЖЭКОН 328
- СПбГИПСР 136
- СПбГЛТУ им. Кирова 227
- СПбГМТУ 143
- СПбГПМУ 146
- СПбГПУ 1599
- СПбГТИ (ТУ) 293
- СПбГТУРП 236
- СПбГУ 578
- ГУАП 524
- СПбГУНиПТ 291
- СПбГУПТД 438
- СПбГУСЭ 226
- СПбГУТ 194
- СПГУТД 151
- СПбГУЭФ 145
- СПбГЭТУ «ЛЭТИ» 379
- ПИМаш 247
- НИУ ИТМО 531
- СГТУ им. Гагарина 114
- СахГУ 278
- СЗТУ 484
- СибАГС 249
- СибГАУ 462
- СибГИУ 1654
- СибГТУ 946
- СГУПС 1473
- СибГУТИ 2083
- СибУПК 377
- СФУ 2424
- СНАУ 567
- СумГУ 768
- ТРТУ 149
- ТОГУ 551
- ТГЭУ 325
- ТГУ (Томск) 276
- ТГПУ 181
- ТулГУ 553
- УкрГАЖТ 234
- УлГТУ 536
- УИПКПРО 123
- УрГПУ 195
- УГТУ-УПИ 758
- УГНТУ 570
- УГТУ 134
- ХГАЭП 138
- ХГАФК 110
- ХНАГХ 407
- ХНУВД 512
- ХНУ им. Каразина 305
- ХНУРЭ 325
- ХНЭУ 495
- ЦПУ 157
- ЧитГУ 220
- ЮУрГУ 309
- О проекте
- Реклама на сайте
- Правообладателям
- Правила
- Обратная связь
Чтобы распечатать файл, скачайте его (в формате Word).
Лечение, симптомы, препараты
Специальные питательные среды – среды, на которых создаются условия для выращивания тех бактерий, которые не растут на простых средах. Кровяной агар или кровяной бульон – получают путем добавления к питательной среде 5-10% подогретой стерильной дефибринированной крови барана, кролика лошади, человека. Среда используется для выделения стрептококков, пневмококков и других бактерий, а также для изучения гемолитической активности. Сывороточный бульон или сывороточный агар получают, путем добавления к простым средам 15-20% лошадиной или бычьей сыворотки. Среда применяется для выделения пневмококков, менингококков. Желчный бульон или желчный агар получают путем добавления к питательной среде медицинской желчи без консерванта, или свежеполученной от крупного рогатого скота. Среда применяется для выделения брюшнотифозных, паратифозных и дизентерийных палочек. Специальные среды для культивирования анаэробных бактерий: среда Китта-Тароцци состоит из питательного бульона, глюкозы и кусочков печени или мясного фаршадля адсорбции кислорода.
Желатин – животный белок, продукт частичного гидролиза коллагена. Имеет вид бесцветных или светло-желтых пластинок без запаха и вкуса. В холодной воде набухает, сильно поглощая воду. При температуре 30°С растворяется, при охлаждении до 20-22°С превращается в гель (студень). Используется в микробиологии для изучения протеолитических ферментов.
Дифференциально-диагностические среды позволяют различить один вид микроба от другого. Принцип построения дифференциально-диагностических сред основан на разной биохимической активности бактерий. В состав дифференциально-диагностических сред входит основная питательная среда, обеспечивающая размножение бактерий, определенный химический субстрат, различное отношение к которому является диагностическим признаком, индикатор, изменение цвета которого свидетельствует о разложении субстрата и образовании кислых продуктов.
Агар Эндо – плотная среда, применяется для выделения и первичной идентификации энтеробактерий. В состав ее входят, кроме питательной основы, лактоза и основной фуксин, обесцвеченный сульфитом и фосфатом натрия. Правильно приготовленная среда бесцветна или имеет слегка розовый оттенок. Колонии бактерий (кишечная палочка), ферментирующие лактозу, окрашиваются на ней в красный цвет; бактерии, не ферментирующие лактозу (сальмонеллы), остаются бесцветными.
Среда Левина (лактозоэозинметиленовый агар) – среда для выделения энтеробактерий. Колонии лактозоферментирующих бактерий окрашены в темно-синий или черный цвет, колонии лактозоотрицательных бактерий вырастают под цвет среды (светло-фиолетового цвета).
Среды Гисса – набор определенных углеводов для изучения ферментативной активности бактерий и их дифференциации по этим признакам.
Элективные питательные среды содержат дополнительные вещества, задерживающие рост грамположительных бактерий. Селективные питательные среды стимулируют рост одних микробов и угнетают рост других. Селективные условия получают путем добавления в среду химических веществ. Так как в этих средах патогенные бактерии размножаются и накапливаются, их называют также средами обогащения.
Среда Плоскирева – плотная питательная среда, содержащая соли желчных кислот, бриллиантовый зеленый, лактозу и индикатор. Эта среда является не только селективной, так как подавляет рост многих микробов и способствует лучшему росту возбудителей брюшного тифа, паратифов, дизентерии, но и дифференциально-диагностической, так как лактозоотрицательные бактерии (шигеллы) образуют на ней бесцветные колонии, а лактозоположительные – кирпично-красные.
Селенитовая среда — является лучшей средой обогащена для сальмонелл и дизентерийных микробов Зонне. Селенит натрии, содержащийся в среде, стимулирует рост этих бактерий и подавляет рост сопутствующей флоры.
Среда Мюллера служит для накопления сальмонелл. К питательной среде добавлют мел, раствор Люголя и гипосульфит натрия. При взаимодействии этих веществ образуется тетратионат натрия, который угнетает рост кишечных палочек, но создает благоприятные условия для размножения сальмонелл.
Висмут-сульфит агар (среда Вильсона-Блера) – содержит соли висмута, бриллиантовую зелень. Сальмонеллы растут на этой среде в виде колоний чернота цвета. Другие виды бактерий на этой среде роста не дают.
Желточно-солевой агар (ЖСА) – среда для выделения стафилококков, содержит до 10% хлорида натрия, что подавляет большинство бактерий, содержащихся в материале. Кроме того, эта среда является и дифференциально-диагностической, так как присутствие яичного желтка позволяет выявить фермент лецитиназу (лецитовителлазу), который образуют патогенные стафилококки. Лецитиназа расщепляет лецитин на фосфорхолины и нерастворимые в воде жирные кислоты, поэтому среда вокруг лецитиназоположительных колоний мутнеет и появляется опалесцирующая зона в виде «радужного венчика».
Теллуритовые среды (сывороточно-теллуритовый агар, кровяно-теллуритовый агар) – селективные среды для выделения дифтерийных бактерий, содержат теллурит калия. Бесцветная соль теллура, содержащаяся в питательной среде, восстанавливается дифтерийными бактериями до металла, окрашивающего колонии в черный цвет.
Щелочной агар элективен для холерных вибрионов, щелочная реакция среды (рН 9,0) не препятствует росту холерных вибрионов, но тормозит рост других микроорганизмов.
Консервирующие среды – среды, содержат добавки, предупреждающие размножение и гибель микробов, что способствует сохранению их жизнеспособности. Консервирующие среды применяются когда нет возможности быстрого посева на питательные среды. Для бактерий наиболее употребительны консерванты:
а) глицериновая смесь, состоящая из 0,5 л химически чистого
глицерина и 1,0 л физиологического раствора.
б) боратная смесь
в) фосфатно-буферная смесь
Для длительного сохранения свежевыделенных и производственных культур применяют полужидкий голодный агар, в этой среде при пониженной жизнедеятельности микробов продукты обмена накапливаются незначительно, что способствует хорошему сохранению культур.
Лечение, симптомы, препараты
Специальные питательные среды – среды, на которых создаются условия для выращивания тех бактерий, которые не растут на простых средах. Кровяной агар или кровяной бульон – получают путем добавления к питательной среде 5-10% подогретой стерильной дефибринированной крови барана, кролика лошади, человека. Среда используется для выделения стрептококков, пневмококков и других бактерий, а также для изучения гемолитической активности. Сывороточный бульон или сывороточный агар получают, путем добавления к простым средам 15-20% лошадиной или бычьей сыворотки. Среда применяется для выделения пневмококков, менингококков. Желчный бульон или желчный агар получают путем добавления к питательной среде медицинской желчи без консерванта, или свежеполученной от крупного рогатого скота. Среда применяется для выделения брюшнотифозных, паратифозных и дизентерийных палочек. Специальные среды для культивирования анаэробных бактерий: среда Китта-Тароцци состоит из питательного бульона, глюкозы и кусочков печени или мясного фаршадля адсорбции кислорода.
Желатин – животный белок, продукт частичного гидролиза коллагена. Имеет вид бесцветных или светло-желтых пластинок без запаха и вкуса. В холодной воде набухает, сильно поглощая воду. При температуре 30°С растворяется, при охлаждении до 20-22°С превращается в гель (студень). Используется в микробиологии для изучения протеолитических ферментов.
Дифференциально-диагностические среды позволяют различить один вид микроба от другого. Принцип построения дифференциально-диагностических сред основан на разной биохимической активности бактерий. В состав дифференциально-диагностических сред входит основная питательная среда, обеспечивающая размножение бактерий, определенный химический субстрат, различное отношение к которому является диагностическим признаком, индикатор, изменение цвета которого свидетельствует о разложении субстрата и образовании кислых продуктов.
Агар Эндо – плотная среда, применяется для выделения и первичной идентификации энтеробактерий. В состав ее входят, кроме питательной основы, лактоза и основной фуксин, обесцвеченный сульфитом и фосфатом натрия. Правильно приготовленная среда бесцветна или имеет слегка розовый оттенок. Колонии бактерий (кишечная палочка), ферментирующие лактозу, окрашиваются на ней в красный цвет; бактерии, не ферментирующие лактозу (сальмонеллы), остаются бесцветными.
Среда Левина (лактозоэозинметиленовый агар) – среда для выделения энтеробактерий. Колонии лактозоферментирующих бактерий окрашены в темно-синий или черный цвет, колонии лактозоотрицательных бактерий вырастают под цвет среды (светло-фиолетового цвета).
Среды Гисса – набор определенных углеводов для изучения ферментативной активности бактерий и их дифференциации по этим признакам.
Элективные питательные среды содержат дополнительные вещества, задерживающие рост грамположительных бактерий. Селективные питательные среды стимулируют рост одних микробов и угнетают рост других. Селективные условия получают путем добавления в среду химических веществ. Так как в этих средах патогенные бактерии размножаются и накапливаются, их называют также средами обогащения.
Среда Плоскирева – плотная питательная среда, содержащая соли желчных кислот, бриллиантовый зеленый, лактозу и индикатор. Эта среда является не только селективной, так как подавляет рост многих микробов и способствует лучшему росту возбудителей брюшного тифа, паратифов, дизентерии, но и дифференциально-диагностической, так как лактозоотрицательные бактерии (шигеллы) образуют на ней бесцветные колонии, а лактозоположительные – кирпично-красные.
Селенитовая среда — является лучшей средой обогащена для сальмонелл и дизентерийных микробов Зонне. Селенит натрии, содержащийся в среде, стимулирует рост этих бактерий и подавляет рост сопутствующей флоры.
Среда Мюллера служит для накопления сальмонелл. К питательной среде добавлют мел, раствор Люголя и гипосульфит натрия. При взаимодействии этих веществ образуется тетратионат натрия, который угнетает рост кишечных палочек, но создает благоприятные условия для размножения сальмонелл.
Висмут-сульфит агар (среда Вильсона-Блера) – содержит соли висмута, бриллиантовую зелень. Сальмонеллы растут на этой среде в виде колоний чернота цвета. Другие виды бактерий на этой среде роста не дают.
Желточно-солевой агар (ЖСА) – среда для выделения стафилококков, содержит до 10% хлорида натрия, что подавляет большинство бактерий, содержащихся в материале. Кроме того, эта среда является и дифференциально-диагностической, так как присутствие яичного желтка позволяет выявить фермент лецитиназу (лецитовителлазу), который образуют патогенные стафилококки. Лецитиназа расщепляет лецитин на фосфорхолины и нерастворимые в воде жирные кислоты, поэтому среда вокруг лецитиназоположительных колоний мутнеет и появляется опалесцирующая зона в виде «радужного венчика».
Теллуритовые среды (сывороточно-теллуритовый агар, кровяно-теллуритовый агар) – селективные среды для выделения дифтерийных бактерий, содержат теллурит калия. Бесцветная соль теллура, содержащаяся в питательной среде, восстанавливается дифтерийными бактериями до металла, окрашивающего колонии в черный цвет.
Щелочной агар элективен для холерных вибрионов, щелочная реакция среды (рН 9,0) не препятствует росту холерных вибрионов, но тормозит рост других микроорганизмов.
Консервирующие среды – среды, содержат добавки, предупреждающие размножение и гибель микробов, что способствует сохранению их жизнеспособности. Консервирующие среды применяются когда нет возможности быстрого посева на питательные среды. Для бактерий наиболее употребительны консерванты:
а) глицериновая смесь, состоящая из 0,5 л химически чистого
глицерина и 1,0 л физиологического раствора.
б) боратная смесь
в) фосфатно-буферная смесь
Для длительного сохранения свежевыделенных и производственных культур применяют полужидкий голодный агар, в этой среде при пониженной жизнедеятельности микробов продукты обмена накапливаются незначительно, что способствует хорошему сохранению культур.
Питательные среды компании HiMedia
| Отечественная питательная среда | Код | HiMedia аналог |
|---|---|---|
| Агар Байрд-Паркер | M043* M1140 | Baird-Parker Agar Base / Baird-Parker Agar Base with Sulpha Основа агара Бэрда-Паркера с сульфаметазином FD046 Egg Yolk Tellurite Emulsion / Эмульсия яичного желтка с теллуритом FD045 Egg Yolk Emulsion / Эмульсия яичного желтка FD047 Potassium Tellurite 3.5% / Теллурит калия 3,5% раствор FD069 B P Sulpha Supplement / Добавка с сульфаметазином для среды Бэрда - Паркера |
| Агар дезоксихолат-цитрат лактозный по Leifson в модификации Hynes | M066 | Deoxycholate Lactose Agar (Hynes) Дезоксихолат - лактозный агар |
| Агар для выделения стафилококков | M521 | Staphylococcus Agar No.110 Агар для выделения стафилококков №110 |
| Агар желточный для анаэробов | M902* | Anaerobic Egg Agar Base Основа анаэробного желточного агара FD045 Egg Yolk Emulsion / Эмульсия яичного желтка |
| M911* | C.botulinum Isolation Agar Base Основа селективного агара для клостридий ботулизма FD049 C.B.I. Supplement / Селективная добавка для клостридий ботулизма FD045 Egg Yolk Emulsion / Эмульсия яичного желтка | |
| Агар желточный с маннитом, полимиксина В или полимиксина М сульфатом и феноловым красным | M833* | Bacillus cereus Agar Base Основа агара для Bacillus cereus FD003 Polymyxin B Selective Supplement / Селективная добавка с полимиксином В FD045 Egg Yolk Emulsion / Эмульсия яичного желтка |
| Агар желточный с натрия хлоридом, полимиксина В или полимиксина М сульфатом и 2, 3, 5-трифенилтетразола хлоридом | M1139* | MYP Agar Base Основа желточного агара с полимиксином FD003 Polymyxin B Selective Supplement / Селективная добавка с полимиксином В FD045 Egg Yolk Emulsion / Эмульсия яичного желтка |
| Агар Клиглера - ГРМ | M078 | Kligler Iron Agar Среда Клиглера |
| Агар Кристенсена с мочевиной | M112* M112I* | Urea Agar Base (Christensen) Основа уреазного агара по (Кристенсену) FD048 Urea 40% / Мочевина 40% раствор |
| Агар лактозный с бриллиантовым зеленым и феноловым красным | M121* | Brilliant Green Bile Broth 2% Желчный бульон с бриллиантовым зеленым |
| Агар МакКонки | M081 MU081 ME081 M081B | MacConkey Agar - Агар МакКонки -«-, по прописи Американской Фармакопеи -«-, по прописи Европейской Фармакопеи -«-, по прописи Британской Фармакопеи |
| Агар микробиологический (Агар-агар) | RM026 | Agar powder, Bacteriological Агар-агар (бактериологический) |
| RM301 ГОСТ | Agar Powder (Extra Pure) Агар-агар (ультрачистый) | |
| Агар питательный (Сухой мясо-пептонный агар) | M012 | Nutrient Agar with 1 % Peptone Питательный агар с 1% пептона |
| M1269 | Nutrient Agar No.2 Питательный агар N2 | |
| M001 | Nutrient Agar Питательный агар | |
| Агар с бриллиантовым зеленым, феноловым красным, лактозой и сахарозой | M016* MU016* ME016* M016B* | Brilliant Green Agar Base, Modified Основа дифференциального агара с бриллиантовым зеленым модифицированного FD068 Sulpha Supplement / Селективная добавка для dsделения сальмонелл |
| Агар с кристаллическим фиолетовым, лактозой, нейтральным красным, глюкозой и желчью | M581 |
Примечание:
пропись сред с кат. № MU000 соответствует требованиям Фармакопеи США, ME000 - Европейской Фармакопеи, M000B - Британской Фармакопеи.
* - для основы среды необходимы селективные, дифференцирующие и/или обогащающие добавки.
Читайте также:

