Посев крови на желчный бульон
Показания. Бактериологическое исследование проводится при подозрении на паратифозное заболевание (наличие лихорадки постоянного, ремиттирующего или неправильно ремиттирующего типа); нарастание симптомов интоксикации параллельно подъему температуры; наличии гипотонии; относительной брадикардии (у детей раннего возраста - тахикардия); дикротии пульса; симптомов поражения органов пищеварения (сухой язык, трещины, утолщения его, отпечатки зубов по его краю, грязно-бурый или коричневый налет); вздутия (метеоризм) живота; урчании и болезненности в правой подвздошной области; положительном симптоме Падалки; задержке стула; гепатолиенальном синдроме на первой неделе заболевания; розеолезной сыпи на 8-10 день болезни; лейкопении с относительным лимфоцитозом или слегка повышенной СОЭ; у всех лихорадящих больных с неустановленным диагнозом, если высокая температура сохраняется более 3 дней.
Посев крови (гемокультура) проводится при наличии подозрения на паратифозное заболевание в любой день болезни; повторно, и особенно в ранние сроки лихорадочного периода до назначения этиотропного лечения.
Розеолокультура (содержимое розеол) берется с 8-10 дня болезни, в периоде реконвалесценции; при стертых формах паратифозных заболеваний, когда возбудители находятся в крови в небольшом количестве.
Посев костного мозга (миелокультура) проводится в атипичных случаях тифопаратифозных заболеваний при отрицательных результатах других лабораторных исследований и посевах крови.
Посев кала (копрокультура) и мочи (уринокультура) проводятся со второй недели болезни.
Посев желчи (биликультура) может проводится в течение всего периода заболевания. Посев желчи противопоказан в лихорадочном периоде.
Для посева крови используют 10% желчный бульон и среду Раппопорта. Можно производить посев в мясопептонный бульон с добавлением 1% глюкозы. Стерильным шприцом из локтевой вены берут кровь на первой неделе заболевания в количестве 10 мл, а в более поздние сроки -15-20 мл крови и засевают во флаконы с теплым бульоном у постели больного в соотношении 1:10 (при меньшем объеме питательной среды кровь может оказать бактерицидное действие на возбудителя). Если посев у постели больного провести нельзя, то в лабораторию посылается цитратная кровь. Во флакончики с 1 мл 40% стерильного раствора вводят 9 мл крови путем прокола пробки предварительно обработанной спиртом.
Для получения содержимого из розеолы кожу над ней обрабатывают этиловым спиртом и скарифицируют. На место скарификации наносят каплю желчного или простого бульона, а затем с помощью пипетки ее переносят во флакон с 50 мл желчного бульона.
Костный мозг получают путем стернальной пункции. Посев проводят во флакон с 50 мл желчного бульона.
Для посева кала стерильной стеклянной палочкой или шпателем берут 2-3 грамма испражнений. Если своевременно провести посев кала нельзя, то можно использовать консервант (глицериновая смесь), составляющий 2/3 общего объема. Посев производят прямым способом на чашку Петри со средами Плоскирева, Левина, с висмут-агаром или на среды обогащения (селенитовая, среда Мюллера) с последующим пересевом на вышеперечисленные среды.
Посев мочи проводят в стерильную посуду (собирают 20-30 мл мочи с соблюдением условий, исключающих ее инфицирование). Затем проводят посев мочи прямым способом на чашки Петри со средой Плоскирева и др.
Посев желчи, полученной при дуоденальном зондировании (не ранее 8-10 дня нормальной температуры) с соблюдением стерильности засевают на чашки Петри по 0,5 мл или на среды обогащения по 1-2 мл или на простой бульон.
Ожидаемые результаты. Предварительные результаты посевов крови - выделение S. Typhi - получают через 2-3 дня, а окончательные - через 5-10 дней. Окончательные результаты бактериологического анализа кала и мочи получают на 4-5 день, а желчи - на 7 день.
Трактовка результатов. Выделение гемокультуры является главным подтверждением диагноза паратифозного заболевания. На ранних стадиях заболевания возбудители выявляются у 40% больных в крови. В некоторых случаях обнаружение паратифозных микроорганизмов в крови не является признаком заболевания. Речь идет о бактерионосителях, у которых любое заболевание может сочетаться с выделением возбудителей брюшного тифа. Выделение возбудителей из мочи обладает повышенной диагностической ценностью в связи с тем, что почечные носители встречаются редко. Копро- урино- биликультуры чаще всего используют для подтверждения бактериологического выздоровления от брюшного тифа и паратифа.
Метод выделения розеолокультуры применяется ограниченно, поскольку экзантема встречается не у всех больных.
Положительные результаты копрокультуры характерны для 2-3 недели болезни, в период вторичной бактериемии, что ограничивает возможности метода.
При отрицательных результатах бактериологического исследования диагноз паратифозного заболевания может основываться на клинико-эпидемиологических данных.
Перед выпиской больных из стационара проводятся трехкратные посевы кала и мочи после отмены антибиотиков с интервалами 1-2 дня и однократным посевом желчи на 10 день нормальной температуры.
Методика бактериологического исследования. Выделение возбудителя из крови (гемокультура) является ранним методом диагностики заболеваний. Бактериемия у больных тифо-паратифозным заболеванием появляется в конце инкубационного периода и не исчезает в течение всего лихорадочного периода болезни и во время рецидивов. Результаты бактериологического исследования в определенной степени зависят от сроков взятия материала и от количества засеваемой крови. Чем раньше от начала болезни произведен посев крови, тем больше вероятность обнаружения возбудителя. На первой неделе брюшного тифа кровь у больного берут из локтевой вены в количество 10 мл, в более поздние сроки и во время рецидивов — 20 мл.
В первый день исследования кровь засевают в соотношении 1:10 в одну из жидких сред. Указанное соотношение необходимо точно соблюдать, так как при меньшем разведении крови микробы могут погибнуть из-за бактерицидного ее действия. Для посева пользуются: 10% или 20% раствором желчного бульона, разлитого по 50—100 мл во флаконы, мясо-пептонным бульоном с добавлением 1 % глюкозы, стерильной дистиллированной водой — по методу Н. Н. Клодницкого, в которой происходит лизис эритроцитов, продукты их распада при этом служат хорошей питательной средой для размножения бактерий. Можно также использовать стерильную водопроводную воду. Лучшие результаты получаются при посевах материала на желчный бульон. Если невозможно произвести посев крови на месте, сыворотку вместе со сгустком или цитратную кровь (10 мл крови выливают в пробирку с 2 мл 5% стерильного натрия цитрата) направляют в лабораторию. Сгусток крови в лаборатории измельчают и засевают в одну из перечисленных сред. Флаконы помещают в термостат при температуре 37° С.
Второй день исследования. Через 14—24 ч от начала исследования производят посев материала в чашку Петри на среду Эндо или среду с эозином и метиленовым синим (среда Левина). Не рекомендуют использовать для посева среду Плоскирева, так как тифо-паратифозные палочки, находящиеся в крови, являются по типу питания облигатными паратрофами и не сразу меняют этот тип питания на метатрофный (то есть мертвыми органическими субстратами). Поэтому на этой среде, содержащей соли желчных кислот, палочки брюшного тифа растут очень плохо либо совсем не растут. При отсутствии роста бактерий после первого посева производят последующие через 48, 72 ч и на 5-е и 10-е сутки. Если при этом возбудитель выделить не удалось, выдается отрицательный ответ. В сомнительных случаях рекомендуют периодически — 1 раз в 3—4 дня — производить посевы до 24-го дня с момента взятия материала. Отрицательный ответ выдается все же на 7-й день.
Третий день исследования. Выросшие на средах Эндо и Левина «подозрительные» колонии (на среде Эндо колонии патогенных микробов бесцветны) идентифицируют, для чего 2—3 колонии пересевают на скошенный агар и среду Ресселя.
Четвертый день исследования. Учитывают и регистрируют результаты посева на среде Ресселя, изучают морфологические свойства выделенных культур в мазке, окрашенном по Граму. Определяют подвижность — наличие или отсутствие жгутиков — в висячей или раздавленной капле, взятой из 4—6-часовой бульонной культуры. Для этого агаровую культуру (одну петлю) засевают в 1 мл слегка подогретого бульона. Пересевают отобранные культуры (2—3 пробирки) на среды Гисса с маннитом, сахарозой и косой агар, а также в 2 пробирки с мясо-пептонным бульоном, в которые под пробки помещают полоски фильтровальной бумаги, смоченные специальными растворами для определения сероводорода и индола (развернутый «пестрый ряд»).
Пятый день исследования. Регистрируют изменения на развернутом «пестром ряду». При наличии газообразования ставят реакцию агглютинации со смесью сальмонеллезных сывороток. При положительной реакции проводят реакцию агглютинации с О- и Н-сыворотками и выдают окончательный ответ на основании совокупности всех признаков.
Выделение миелокультуры осуществляют путем посева полученного пунктата костного мозга в 3—5 мл бычьей стерильной желчи или в 25—30 мл 10% желчного бульона, ставят его в термостат и на следующий день производят пересев на среды Эндо или Вильсона — Блера. В дальнейшем этапы исследований те же.
Выделение бактерий из кала. С 8— 10-го дня болезни, чаще с третьей недели, у больных брюшным тифом, паратифами выделяются с испражнениями бактерии. Для исследования берут последние порции кала жидкой консистенции, эмульгируют в изотоническом растворе натрия хлорида (в соотношении 1:10) и оставляют на 30 мин до оседания крупных частиц. Для посева каплю материала берут с поверхности жидкости.
В первый день исследования материал засевают на среды обогащения — желчный бульон, среды магниевую, Мюллера, Кауфмана — и ставят в термостат. На второй день исследования со среды обогащения делают посев на чашки со средами Плоскирева, Эндо или Левина и Вильсона — Блера (висмут-сульфит-агар). В последующем этапы исследования те же, что при выделении гемокультуры.
Выделение бактерий тифо-паратифозной группы из мочи лучше производить со второй третьей недели болезни. Перед взятием материала следует обмыть стерильным изотоническим раствором натрия хлорида наружное отверстие мочеиспускательного канала; у женщин лучше брать мочу катетером. Для исследования берут 20—30 мл мочи. После центрифугирования осадок засевают в 2 чашки со средой Плоскирева или висмут-сульфит-агаром. Надосадочную жидкость засевают на среду обогащения (10% желчный бульон) и ставят в термостат на 24 ч, после чего производят посев в 2 чашки одной из элективных сред. Выделенные колонии идентифицируют обычным способом.
Исследование дуоденального содержимого — желчи. Метод чаще применяют в стадии реконвалесценции. Желчь собирают во время зондирования в стерильные пробирки. Дуоденальное содержимое засевают во флаконы с 50 мл бульона, а оставшуюся часть материала вместе с посевами помещают в термостат при 37° С. На следующий день делают посев в 2 чашки с плотной дифференциальной средой. Выделенные колонии идентифицируют по описанной методике.
Высокочувствительным и перспективным в ранней диагностике брюшного тифа и паратифов является метод иммунофлюоресценции, с помощью которого исследуют кровь с первых дней болезни, кал с 10-го дня, дуоденальное содержимое на 10-й день нормальной температуры тела. Специфическими флюоресцирующими сыворотками маркируют тифо-паратифозные бактерии, которые в последующем определяют при люминесцентной микроскопии. Метод позволяет диагностировать заболевание через 10—12 ч от начала исследования.
Серологическая диагностика тифо-паратифозных заболеваний. Со второй недели заболевания в крови больных появляются специфические антитела, которые можно определить с помощью реакции Видаля. При брюшном тифе и паратифах накапливаются О-, а затем и Н-агглютинины. В течение заболевания иногда обнаруживают и Vi-агглютинины, но последние, в отличие от но-сительства, не имеют диагностического значения. Определение в крови больных специфических агглютининов к возбудителю брюшного тифа и паратифов (реакция Видаля) может оказать помощь в установлении диагноза как в остром периоде болезни, так и во время реконвалесценции.
При сальмонеллезах реакция Видаля является подсобным методом диагностики. Следует помнить, что нередко встречаются формы болезни со слабо выраженным иммунологическим ответом. Особенно часто низкие титры агглютининов, вплоть до их отсутствия, отмечают у больных, леченных антибиотиками.
Для реакции Видаля берут 1—3 мл крови из пальца или локтевой вены в стерильную пробирку. С целью ускорения свертывания крови ее ставят в термостат на 30 мин. Свернувшуюся кровь обводят стеклянной пипеткой и помещают в холодильник до появления прозрачной отстоявшейся сыворотки. Сгусток используют для посева (гемокультура). Реакцию агглютинации ставят с Н- и О-брюшнотифозными, А- и В-паратифозными диагностикумами. Сыворотку разводят, начиная с титра 1:100 до 1:800, по следующей методике. В пробирку наливают 9,9 мл стерильного изотонического раствора натрия хлорида и 0,1 мл испытуемой сыворотки — получают разведение 1:100. В 4 опытные пробирки (по числу антигенов, используемых в реакции Видаля), и в одну, служащую контролем сыворотки, разливают 5 мл разведенной сыворотки по 1 мл. Из оставшихся 5 мл сыворотки (разведения 1:100) 1 мл выливают, а к 4 мл добавляют 4 мл изотонического раствора натрия хлорида и получают разведение 1:200. 4 мл из разведения 1:200 разливают также в 4 пробирки по 1 мл, а к оставшимся 4 мл вновь добавляют 4 мл изотонического раствора натрия хлорида для получения разведения 1:400. Последующие разведения (1:800, 1:1600) производят описанным способом. В 4 пробирки, являющиеся контролем антигенов, вливают по 1 мл изотонического раствора хлорида натрия. Во все опытные пробирки, исключая, те, которые служат контролем сыворотки, вливают по 1—2 капли соответствующих диагностикумов. Штатив с пробирками встряхивают и помещают в термостат при 37° С на 24 ч. Н-агглютинация (крупнохлопчатая) наступает через 2 ч, О-агглютинация (мелкозернистая) — значительно позже. Интенсивность реакции отмечают через 24 ч. Диагностический титр реакции Видаля в разведении не менее чем 1:200 при наличии клинических проявлений.
Следует учитывать, что эта реакция может быть положительной при других заболеваниях — туберкулезе, малярии, бруцеллезе, злокачественных новообразованиях и некоторых состояниях (беременности). Реакция Видаля может быть положительной и у здоровых лиц (бытовая реакция), у привитых и перенесших в прошлом заболевание (анамнестическая реакция). Для повышения специфичности реакции Видаля Фишер предложил разводить сыворотку гипертоническим раствором натрия хлорида (2,9 и 5,8%). Это приводит к ослаблению или ликвидации групповых реакций. Ценность реакции агглютинации повышается при повторных исследованиях, когда с динамикой заболевания устанавливают нарастание титра антител. При паратифе А реакция Видаля может быть отрицательной либо титр специфических антител меньше групповых.
В последние годы для распознавания кишечной группы заболеваний широко применяют реакцию пассивной гемагглютинации (РПГА) с парциальными антигенами брюшнотифозных бактерий. РПГА отливается высокой чувствительностью и специфичностью, бывает положительной с 5-го дня болезни. Минимальный диагностический титр у больных брюшным тифом, паратифами, сальмонеллезом с О-антигеном — 1:200. Реакцию ставят в динамике для определения нарастания титра антител.
Методы лабораторной диагностики бактерионосительства при брюшном тифе и паратифах. Бактериологическое исследование кала, мочи и дуоденального содержимого проводят по общепринятым методам. Лучшие результаты получают при использовании селенитовых сред.
В связи с периодичностью выделения бактерий нередко не удается высеять возбудителя. У подавляющего большинства носителей палочек брюшного тифа обнаруживают микробы, содержащие Vi-антиген, в связи с чем в крови острых и хронических носителей появляются Vi-антитела (в крови больных они бывают реже). Диагностический титр реакции 1:20 и выше. Параллельно с реакцией Vi-агглютинации (с прогретой сывороткой) ставится реакция Видаля (с нативной сывороткой) с Н- и О-брюшнотифозными диагностикумами. В сыворотках брюшнотифозных бактерионосителей Н-антитела в титре от 1:200 до 1:800 встречаются в 60—80% случаев. Наличие сочетания Н- и Vi-антител имеет особое диагностическое значение в выявлении носителей палочек брюшного тифа.
Из дополнительных методов исследования для выявления носительства палочек брюшного тифа применяют кожно-аллергическую пробу с тифином, а также РПГА с Vi-антигеном.
Таким образом, важным условием успеха борьбы с тифо-паратифозными заболеваниями является раннее и полное выявление и обезвреживание источника инфекций. В настоящее время брюшной тиф встречается спорадически. При этом течение болезни менее длительное и не сопровождается всеми типичными для классической формы признаками, что затрудняет клиническое распознавание.
В связи с изложенным комплексное лабораторное обследование приобретает важное значение.
После установления предварительного диагноза на основании клинико-эпидемиологических данных возникает необходимость в проведении специфических лабораторных исследований, особенно это касается атипичных форм заболевания. Только с помощью лабораторных методов исследования можно диагностировать бактерионосительство и дифференцировать брюшной тиф от паратифов А и В. Бактериологическому исследованию при тифопаратифозных заболеваниях подвергается кровь, содержимое розеол, пунктат костного мозга, кал, моча и желчь.
Наиболее ранним и достоверным методом лабораторной диагностики является посев крови (гемокультура). Его нужно делать всегда при подозрении на тифопаратифозное заболевание в любой день болезни, когда у больного повышена температура. Однако надо помнить, что чем раньше от начала заболевания производится посев, тем больше шансов получить положительный результат. И наоборот, чем позже берется кровь, тем меньшее количество возбудителей находится в крови и положительные результаты бывают реже, а при нормальной температуре совсем редко. Для повышения положительных результатов гемокультуры рекомендуется при отсутствии противопоказаний за 15- 20 мин до взятия крови ввести подкожно 1 мл 0,1 % раствора адреналина, что способствует сокращению селезенки и выходу в кровяное русло возбудителей.
Для посева крови используются 10 % желчный бульон и среда Рапопорт. Стерильным шприцом из локтевой вены на первой неделе болезни берут 10 мл крови, а в более поздние сроки - 15-20 мл и засевают у постели больного на питательную среду в отношении 1 : 10 (при меньшем объеме питательной среды кровь может оказать бактерицидное действие на микроб-возбудитель). Наличие желчи в средах способствует росту тифопара-тифозных микробов, задерживает действие бактериофага, препятствует свертыванию крови. При отсутствии сред, содержащих желчь, посев крови можно произвести в мясопептонный бульон с 1 % глюкозы (соотношение крови и среды 1 : 10), по методу Клодницкого на стерильную водопроводную или дистиллированную воду с 0,1 % агара (10 мл крови на 80-100 мл воды) или по способу Самсонова (5-10 мл крови засевают на 200- 250 мл стерильной водопроводной воды). На этих средах бактерии вырастают не хуже, чем на средах с желчью.
Если посев крови у постели больного произвести нельзя, а также при обследовании большого числа лихорадящих больных рекомендуется пересылать в лабораторию цитратную кровь. Для этого в герметически укупоренные и заранее простерилизованные пенициллиновые флакончики с 1 мл 40 % стерильного раствора натрия цитрата вводят 9 мл крови путем прокола пробки, предварительно обработанной спиртом. В отдельных случаях может использоваться посев оставшегося после постановки реакции Видаля сгустка крови, измельченного стеклянной палочкой.
Предварительный результат посева обычно получают через 2-3 дня, а окончательный - через 5- 10 дней. Положительные результаты гемокультуры чаще бывают при тяжелой форме болезни. Увеличение кратности посевов крови (3 дня подряд) значительно повышает вероятность выделения из нее микробов. Применение антибиотиков (левомицетина, тетрациклина и ампициллина) для лечения больных тифопаратифозными заболеваниями уменьшает количество положительных результатов гемокультуры, поскольку через 2-4 дня от начала лечения из крови исчезает возбудитель. Поэтому следует как можно раньше производить посев крови, еще до назначения больным антибиотиков.
Опыт показывает, что выделение гемокультуры является главным в подтверждении диагноза тифопара-тифозного заболевания, особенно в ранние сроки лихорадочного периода. Так, исследование крови, взятой у больного из вены в первые сутки лихорадки до назначения этиотропной терапии, обеспечивает высеваемость до 95-100 %, в последующие дни она снижается до 50— 60 %, а через 10—14 дней -до 5%.

Посев крови – метод бактериологического исследования, использующийся для достоверного определения наличия бактерий в крови.
Посев используют для выявления в ней различных микроорганизмов приходится делать при многих заболеваниях. Посев крови осуществляют для обособленности, чтобы идентифицировать болезнетворных бактерий при бактериемии.
Бактериемия - это проникновение бактерий в кровь при генерализации инфекции в организме человека, заражении крови (сепсис). Данный вид анализа проводится в лабораториях медицинских учреждений.
Делают посев крови на жидкие питательные среды:
- желчный бульон,
- сахарный бульон,
- жидкие и полужидкие среды для выращивания микробов анаэробов.
Сколько раз нужно сдавать Бак посев крови
Для обнаружения микроорганизмов требуется несколько анализов не менее 3, так как количество бактерий в крови может колеблется.
Определенные виды бактерий можно выделить только специальными бактериологическими посевами (бак посев) крови.
Бак посев крови - что показывает
Бак посев крови показывает чувствительность к антибиотикам той или иной группы бактерий. Определив вид выращенной колоний бактерий после посева, (микробиологического исследования) можно подобрать эффективные антибиотики против именно этой группы микроорганизмов (так называемый посев крови на стерильность).
- Это важно! Перед анализом на посев крови на инфекции - Не принимайте анатибиотики!
Обнаружить бактерии будет трудно или вообще невозможно, если человек перед анализом посева крови принимал антибиотики, при продолжающемся инфицировании болезнетворными микроорганизмами.
Как сдавать кровь на бак посев
Для наиболее точного диагностирования заболеваний недостаточно самого современного лабораторного оборудования.
Точность результатов зависит не только от используемых реактивов и аппаратуры, но и от времени и правильности сбора исследуемого материала. При несоблюдении основных правил подготовки к анализам их результаты могут быть значительно искажены.
Для исследования крови более всего подходят утренние часы
Для большинства исследований кровь берется строго натощак.
Кофе, чай и сок – это тоже еда.
Можно пить воду.
Рекомендуются следующие промежутки времени после последнего приема пищи:
- для общего анализа крови не менее 3-х часов;
- для биохимического анализа крови желательно не есть 12-14 часов (но не менее 8 часов).
За 2 дня до обследования необходимо отказаться от алкоголя, жирной и жареной пищи.
За 1-2 часа до забора крови не курить.
Перед исследованием крови следует максимально снизить физические нагрузки.
- Исключить бег, подъем по лестнице.
- Избегать эмоционального возбуждения.
- Минут10-15 нужно отдохнуть, расслабиться и успокоиться.
Нельзя сдавать кровь сразу после физиотерапевтических процедур, ультразвукового и рентгенологического исследования, массажа и рефлексотерапии.
Перед сдачей крови нужно исключить перепады температур, то есть баню и сауну.
Перед гормональным исследованием крови у женщин репродуктивного возраста следует придерживаться рекомендаций лечащего врача о дне менструального цикла, в который необходимо сдать кровь, так как на результат анализа влияют физиологические факторы фазы менструального цикла.
Перед сдачей крови необходимо успокоиться, чтобы избежать немотивированного выброса в кровь гормонов и увеличение их показателя.
Для сдачи крови на вирусные гепатиты желательно за 2 дня до исследования исключить из рациона цитрусовые, оранжевые фрукты и овощи.
Для правильной оценки и сравнения результатов ваших лабораторных исследований рекомендуется проводить их в одной и той же лаборатории
В разных лабораториях могут применяться разные методы исследования и единицы измерения показателей.
Бак посев можно назвать древним анализом, однако его популярность от этого отнюдь не падает, хотя современная бактериология имеет возможности найти и выделеть не только штаммы, но и отдельной клетки из него, которая называется клоном.
Однако для получения клона необходим специальный прибор – микроманипулятор, который в обычных лабораториях отсутствует, поскольку применяется, в основном, в научно-исследовательских целях (генетические исследования).
Посев менструальной крови на туберкулез
Результат оценивается после трехкратного посева. На посев берутся выделения из влагалища, менструальную кровь, соскоб или смыв эндометрия, содержимое очагов воспаления (например, из язв на шейке матки).
Даже проведение трехкратного посева дает низкий процент высеваемости палочек Коха. В дополнение используют ПЦР полученного биологического материала.
Посев крови на грибковые инфекции
Количественную оценку грибковой инфекции можно дать с помощью посева грибков (культуральный метод).
Для таких целей материал с кожи, ногтей или волос собирают, как и в случае микроскопического исследования, далее:
- Биологический материал переносят в специальную питательную среду.
- Если во взятых образцах были грибки, то через некоторое время вырастают колонии.
- Затем колонии изучаются под микроскопом, что позволяет определить род и вид грибка, а также его концентрацию.
Кроме того, возможно и проведение тестов на чувствительность грибков к определенным противогрибковым препаратам, что позволяет подобрать больному оптимальную схему лечения.
Посев крови на аэробные и анаэробные бактерии
Посев крови необходим для определения возбудителя инфекционного процесса. В норме кровь является стерильной и только при определенной части заболеваний, в нее могут проникать микроорганизмы.
Такой тип инфицирования называется бактериемией.
Наиболее тяжелый вариант бактериемии – сепсис (септицемия, септикопиемия), но данное состояние проявляется яркой клинической картиной и в основном является уделом стационаров (в том числе отделения реанимации).
Не всегда наличие возбудителя в крови приводит к сепсису. Возможна даже физиологическая бактериемия (она кратковременная и может возникать, например, при чистке зубов и неосторожном травмировании десен).
И все же, если микроорганизм попал в кровь, необходимо его выделить, определить и выяснить, к каким антимикробным препаратам он может быть чувствителен.
В этом случае применяется посев на аробные и анаэробные бактерии.
Аэробные бактерии имеют зависимость от кислорода (то есть их размножение без кислорода невозможно или возможно, но очень кратковременно).
Анаэробные бактерии в свою очередь имеют способность размножаться и без присутствия вокруг них источников кислорода.
Другое название для посева на аэробные и анаэробные бактерии является посев крови на стерильность.
Как и в любом другом исследовании, посев может быть ложноотрицательным, это связано со спецификой забора крови при данном исследовании (очень часто, забор крови нужно проводить на высоте лихорадки – повышения температуры тела).
Ложноположительный результат – при несоблюдении правил стерильности лабораторного инструментария, что в современных лабораториях крайне недопустимо и обычно такого не происходит.
В некоторых случаях для подтверждения диагноза необходимо использовать трехкратный посев на стерильность, то есть кровь забирается три раза с небольшим промежутком во времени.
После успешного забора крови для посева на аэробные и анаэробные бактерии, данный материал помещают на питательную среду. В течение определенного времени начинается рост колоний бактерий, присутствующих в кровотоке пациента.
При помощи различных лабораторных тестов исследователь проводит идентификацию бактерии, а также выполняет тест на чувствительность к антибактериальным препаратам, что в дальнейшем поможет лечащему врачу назначить наиболее эффективное лечение болезни.
Бак посев крови на стафилококк
Если возникает подозрение, что в теле развивается стафилококк, в первую очередь, не надо паниковать.
Обнаружение стафилококка клиническом посеве в концентрации 10 в 3 степени при бессимптомном носительстве не угрожает человеку. Вам необходимо обратить внитание на укрепление иммунитета.
Для точного определения, стафилококк ли является возбудителем заболевания, у больного берут на исследование биоматериалы. Это может быть кровь, содержимое гнойничков, отходящая мокрота, а в некоторых ситуациях и спинномозговая жидкость.
Значимые показатели анализа – выявление в сыворотке крови антител к антигенам стафилококка. Для этого используют реакцию торможения гемолиза, реакцию пассивной гемагглютинации. Одновременно проверяется чувствительность бактерии к различным противомикробным препаратам, чтобы в последующем сделать правильный выбор лекарства для борьбы с ним.
В случае если человек относится к группе пациентов с повышенным риском стафилококковой инфекции (из-за перенесенных заболеваний, других причин, вызвавших ослабление иммунной системы), врач может рекомендовать прохождение быстрого теста на коагулазу.
Такое тестирование – надежный способ определения кокков в крови. Если он покажет положительный результат – значит возбудителем стал золотистый стафилококк, если отрицательный – эпидермальный или сапрофитный.
Посев крови на гемокультуру - алгоритм

Итак, материалом для бактериологического посева является кровь в количестве 5 – 10 мл, полученная из локтевой вены.
Участок кожи обрабатывается сначала ватным шариком, смоченным в 70 % - ном этиловом спирте, а затем другим ватным шариком, смоченным в 1 – 2 % - ном растворе йода, до полного высыхания кожи.
Алгоритм здесь может быть такой же, как и при заборе крови вакуумными шприцами с той разницей, что вместо пробирки в переходник вставляется гемокультурный флакон.
В месте венепункции йод вытирают спиртом и заклеивают этот участок пластырем. Пластиковую крышку данного флакона отламывают, обеззараживают внутреннюю поверхность крышки 70 % этиловым спиртом.
При температуре 37°С кровь нужно хранить не более 2–х часов!
Лучше всего произвести посев крови на питательную среду сразу после её забора.
Соотношение крови и питательной среды – 1: 10,осторожно перемешать.
Для получения наиболее достоверного результата проведение анализа должно быть как минимум двоекратным из разных рук с интервалом времени в 30 минут.
Достоинства посева крови этим методом
Вышеописанного метода в том, что имеет он адекватную стоимость, высокую информативность, простоту в выполнении, а главное – доступность!
В настоящее время существуют два способа посева крови на питательную среду и определение чувствительности к антибиотикам:
- посев на флору с выявлением чувствительности к широкому спектру антибиотиков;
- посев на флору с выявлением чувствительности к основному спектру антибиотиков.
Видео: Анализ на стерильность крови
После установления предварительного диагноза на основании клинико-эпидемиологических данных возникает необходимость в проведении специфических лабораторных исследований, особенно это касается атипичных форм заболевания. Только с помощью лабораторных методов исследования можно диагностировать бактерионосительство и дифференцировать брюшной тиф от паратифов А и В. Бактериологическому исследованию при тифопаратифозных заболеваниях подвергается кровь, содержимое розеол, пунктат костного мозга, кал, моча и желчь.
Наиболее ранним и достоверным методом лабораторной диагностики является посев крови (гемокультура). Его нужно делать всегда при подозрении на тифопаратифозное заболевание в любой день болезни, когда у больного повышена температура. Однако надо помнить, что чем раньше от начала заболевания производится посев, тем больше шансов получить положительный результат. И наоборот, чем позже берется кровь, тем меньшее количество возбудителей находится в крови и положительные результаты бывают реже, а при нормальной температуре совсем редко. Для повышения положительных результатов гемокультуры рекомендуется при отсутствии противопоказаний за 15- 20 мин до взятия крови ввести подкожно 1 мл 0,1 % раствора адреналина, что способствует сокращению селезенки и выходу в кровяное русло возбудителей.
Для посева крови используются 10 % желчный бульон и среда Рапопорт. Стерильным шприцом из локтевой вены на первой неделе болезни берут 10 мл крови, а в более поздние сроки - 15-20 мл и засевают у постели больного на питательную среду в отношении 1 : 10 (при меньшем объеме питательной среды кровь может оказать бактерицидное действие на микроб-возбудитель). Наличие желчи в средах способствует росту тифопара-тифозных микробов, задерживает действие бактериофага, препятствует свертыванию крови. При отсутствии сред, содержащих желчь, посев крови можно произвести в мясопептонный бульон с 1 % глюкозы (соотношение крови и среды 1 : 10), по методу Клодницкого на стерильную водопроводную или дистиллированную воду с 0,1 % агара (10 мл крови на 80-100 мл воды) или по способу Самсонова (5-10 мл крови засевают на 200- 250 мл стерильной водопроводной воды). На этих средах бактерии вырастают не хуже, чем на средах с желчью.
Если посев крови у постели больного произвести нельзя, а также при обследовании большого числа лихорадящих больных рекомендуется пересылать в лабораторию цитратную кровь. Для этого в герметически укупоренные и заранее простерилизованные пенициллиновые флакончики с 1 мл 40 % стерильного раствора натрия цитрата вводят 9 мл крови путем прокола пробки, предварительно обработанной спиртом. В отдельных случаях может использоваться посев оставшегося после постановки реакции Видаля сгустка крови, измельченного стеклянной палочкой.
Предварительный результат посева обычно получают через 2-3 дня, а окончательный - через 5- 10 дней. Положительные результаты гемокультуры чаще бывают при тяжелой форме болезни. Увеличение кратности посевов крови (3 дня подряд) значительно повышает вероятность выделения из нее микробов. Применение антибиотиков (левомицетина, тетрациклина и ампициллина) для лечения больных тифопаратифозными заболеваниями уменьшает количество положительных результатов гемокультуры, поскольку через 2-4 дня от начала лечения из крови исчезает возбудитель. Поэтому следует как можно раньше производить посев крови, еще до назначения больным антибиотиков.
Опыт показывает, что выделение гемокультуры является главным в подтверждении диагноза тифопара-тифозного заболевания, особенно в ранние сроки лихорадочного периода. Так, исследование крови, взятой у больного из вены в первые сутки лихорадки до назначения этиотропной терапии, обеспечивает высеваемость до 95-100 %, в последующие дни она снижается до 50— 60 %, а через 10—14 дней -до 5%.
Метод получения гемокультуры является убедительным при диагностике брюшного тифа и паратифов, но он может применяться и при лихорадочных состояниях неустановленной этиологии, связанных иногда с энтеробактериями. Наилучшие результаты дает посев крови, взятой в самом начале заболевания, даже в первые его часы, однако при отрицательных результатах исследования целесообразен повторный посев крови в течение всего периода лихорадки, а также в разгаре рецидивов.
При взятии крови особенно строго соблюдают требования асептики. Участок кожи в области локтевой вены тщательно обрабатывают спиртом, смазывают йодом, затем вновь протирают спиртом, после чего не следует пальпировать участок предполагаемого введения иглы.
Кровь берут стерильным шприцем в количестве от 10 до 15-20 мл (в зависимости от сроков заболевании и выраженности клинических проявлений) и тут же у постели больного с соблюдением правил асеитики вносят во флаконы с десятикратно превышающим объемом жидкой накопительной среды (среда Рапопорт, 10—20% желчный бульон) или стерильной дистиллированной (по Клодницкому), или водопроводной (по Самсонову) воды. Для ускорения выделения гемокультуры может быть использован посев по Блинкину (1948, 1963).
В плоский флакон (?50 мл), на двух противоположных стенках которого скошен питательный aгap, содержащий 1% глюкозы и 1% лактозы соответственно, вносят 100—150 мл желчного бульона и после контроля на стерильность засевают кровь в обычном соотношении i : 10.
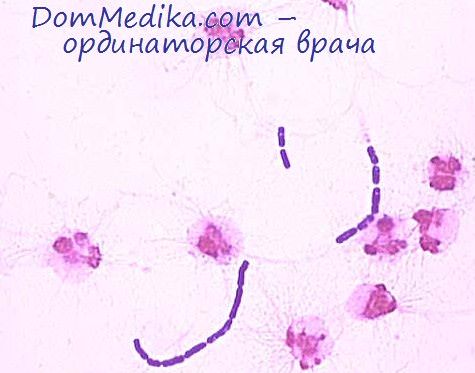
В отдельных случаях для посева на гемокультуру берут сгустки крови, направляемой для серологических исследований. Все манипуляции при этом проводят строго асептически, после «обведения» сгустка и отсасывания сыворотки сгусток растирают в пробирке стеклянной палочкой и вносят в среду обогащения также в соотношении 1 : 10.
Рвотные массы и промывные воды желудка исследуют при острых кишечных заболеваниях, сопровождающихся соответствующей симптоматикой. Для бактериологического исследования используют первые порции промывных вод без добавления пермапганата калия или других дезинфицирующих средств. Материал (50—100 мл) доставляют в лабораторию в стерильных банках с соблюдением упомянутых выше требований. Рвотные массы нейтрализуют 10% раствором натрия гидрокарбоната.
Желчь (дуоденальное содержимое) подвергают исследованию для выявления бактерионосителей, а также с диагностической целью при наличии соответствующих показаний.
Моча подвергается бактериологическому исследованию по различным показаниям: выделение уринокультуры при брюшном тифе и паратифах (2—3-я неделя заболевания), обследование на бактерионосительство, установление этиологии гнойно-воспалительных заболеваний мочевой системы. Пунктат костного мозга, получаемый при стернальной пункции в лечебном учреждении, исследуют в особых случаях, когда получение культур из других материалов оказалось безуспешным. Костный мозг (0,5—0,75 мл) вносят в 3 мл стерильной бычьей желчи, желчный бульон или в среду Рапопорт.
Анализ крови Бактериологический посев крови назначают для подтверждения или исключения наличия в крови микроорганизмов: бактерий (бактериемия) или грибов (фунгемия). Этот анализ показан в следующих клинических случаях:
- Подозрение на сепсис (системная воспалительная реакция, вызванная инфекцией).
- Диагностика заболеваний, при которых характерно распространение инфекции с кровотоком (например, остеомиелит – инфекционное поражение костной ткани, костного мозга и окружающих тканях; инфекционный артрит – инфекционное поражение тканей суставов; эндокардит – инфекционное поражение внутренней оболочки сердца и т.д.). То есть, при положительном результате анализа на бактериологический посев крови есть основание ставить диагноз этих состояний.
- Лихорадка (повышение температуры тела и озноб) неясного генеза (когда в течение 10 дней и более наблюдается повышение температуры тела без видимой причины). Обследование таких пациентов обычно подразумевает бактериологический посев крови с целью обнаружения возбудителя.
ПРИНЦИПЫ МИКРОБИОЛОГИЧЕСКОГО АНАЛИЗА КРОВИ
Основная задача микробиологического анализа крови – исследовать биологический материал на наличие микроорганизмов (бактерий или грибов). Определить наличие бактерий в образце крови (подтвердить или исключить) путем только микроскопического исследования невозможно, поскольку в ней содержится недостаточное количество микробов. Чтобы выявить наличие микроорганизмов, их нужно размножить в жидкой питательной (культуральной) среде, в которой содержаться все необходимые компоненты для успешного роста. При добавлении в культуральную среду образца крови, контейнер инкубируется при оптимальной для роста микроорганизмов (+37°C) до момента, когда культура микробов не становится заметной. Сроки инкубации образца занимают, как правило, от 6-18 часов до нескольких дней и даже недель (если определяются микроорганизмы с медленным ростом). Практический лабораторный опыт показывает, что если в течение 3-х дней инкубации не наблюдается очевидный рост бактерий, то вероятность наличия инфекции в культуре (то есть образце крови, который был помещен в культуральную среду) очень низкая. Несмотря на это, за культурой продолжают наблюдение, поскольку в ней могут обнаруживаться медленно растущие виды микроорганизмов.
В случае обнаружения видимого роста микроорганизмов, обогащенная бактериями культура окрашивается, после чего исследуют под микроскопом. Микроскопическое исследование выращенной в образце крови культуры – первый шаг идентификации вида микроорганизмов (палочки, грамотрицательные или грамположительные кокки и т.д.). Для более точной идентификации выполняют посев жидкой культуры на плотной среде в чашке Петри. В плотной культуральной среде (в чашке Петри) наблюдают рост колоний микроорганизмов, каждая из которых размножается только от одной единственной бактериальной клетки. Затем из одной колонии берут образец, над которым проводят химические исследования. Именно химические тесты позволяют точно определить вид микроорганизма.
После выделения и идентификации вида микроорганизма, определяют их чувствительность к антибактериальным препаратам. Полученные данные позволяют назначить пациенту максимально эффективную терапию (лечение).
Нужно отметить, что бактериемия и фунгемия – опасные состояния, представляющие угрозу жизни, поэтому требуют срочной терапии антибактериальными препаратами. При подозрении на эти состояния, учитывая клиническую картину, лечение назначают немедленно, не дожидаясь результатов микробиологического исследования. При этом, когда известен результат лабораторного анализа (особенно показатели чувствительности к антибиотикам, который, как правило, лаборатории выдают через 3-4 дня), в случае необходимости, антибактериальный препарат может быть заменен на более эффективный.
Забор крови
Главная цель при заборе образца крови – поместить полученный образец в контейнер с культуральной средой, при этом необходимо избегать любое возможное загрязнение (с кожи больного, рук медицинского персонала, из окружающей среды и т.д.).
Время забора крови
Забор образца крови для проведения микробиологического анализа нужно проводить до начала антибиотикотерапии. В противном случае рост микроорганизмов в культуре может быть отсрочен или полностью предотвращен, что приведет к получению ложноотрицательного результата.
Если у пациента перемежающаяся лихорадка (febris intermittis; быстрое, значительное повышение температуры тела, которая держится несколько часов, после чего также быстро опускается до нормальных значений), забор крови необходимо проводить (по мере возможности) в момент повышение температуры тела или сразу же после прохождения пика температурного показателя – в этот период максимально повышается количество микроорганизмов в крови.
Большинство лабораторий рекомендуют проводить второй забор крови не позднее чем через 1 час после первого забора. Таким образом повышаются шансы выявления инфекции, а также появляется возможность отличить истинную бактериемию (при истинной бактериемии микробы обнаруживаются в обоих образцах крови) от бактериального загрязнения.
Контейнеры для культивирования образца крови
Образец крови собирают в специальные стерильные контейнеры с жидкой культуральной средой. Существует несколько видов таких контейнеров, содержащих культуральную среду, которая представляет собой жидкую смесь питательных компонентов, обеспечивающих рост микроорганизмов.
Для забора образца крови на бактериальный посев многие лаборатории предоставляют два вида контейнеров: один контейнер содержит кислород над жидкой средой (кислород необходим для роста аэробных микроорганизмов), другой – смесь газов без кислорода (для культивирования микробов, которые развиваются только в условиях отсутствия кислорода). В этом случае образец крови собирается в оба контейнера.
Необходимый объем крови
При бактериемии в 1 мл крови может содержаться всего лишь одна микробная клетка, поэтому недостаточное количество крови, собранной в контейнер с культуральной средой, может быть причиной получения ложноотрицательного результата анализа.
Тем не менее ложноотрицательный результат можно получить и при внесении в культуральную среду очень большого количества крови. Дело в том, что в культуре кровь продолжает оказывать бактерицидное действие, если она не разведена до достаточной степени в культуральной среде. Для получения достоверного результата анализа нужно соблюдать необходимые пропорции крови и культуральной среды, чтобы соблюсти эффект разведения. Оптимальным разведение крови в культуральной среде считается пропорция 1:10. При этом необходимый объем крови (как правило 5-10 мл) зависит непосредственно от самой культуральной среды, которая внесена в контейнер для сбора биологического материала.
Важно, чтобы в каждый контейнер было внесено то количество крови, которое требует бактериологическая лаборатория.
Техника забора крови
При сборе образца крови на микробиологический анализ необходимо строго придерживаться правил асептика, чтобы исключить бактериальное загрязнение культуры. При условии соблюдения правил, в контейнер с культуральной средой попадает только тот микроорганизм, который содержится в крови пациента.
- Забор образца крови проводят только из периферической вены. При этом нельзя использовать постоянный венозный катетер, так как он может быть загрязнен бактериями.
- Процедура забора образца крови проводится в стерильных перчатках. Место венепункции необходимо обработать соответствующим дезинфицирующим раствором и подождать, пока он высохнет (венепункция должна проводиться на сухой коже). Также необходимо продезинфицировать поверхность контейнера с культуральной средой (особенно крышку), куда будет помещен образец крови.
- Венепункция проводится стерильными шприцом и иглой (к месту пункции руками не прикасаться).
- В контейнер с культуральной средой кровь вносят через закрывающую его резиновую пробку. Резиновую пробку никогда нельзя снимать с контейнера, так как в культуральную среду могут попасть бактерии из окружающей среды.
- Если у пациента нужно взять кровь для проведения сразу нескольких анализов, в первую очередь нужно заполнить контейнер с культуральной средой. Таким образом предотвращают попадание микроорганизмов с другой лабораторной посуды.
- Контейнер с культурой крови должен быть промаркирован (на этикетке должны быть внесены точные данные пациента) и вместе с сопроводительной документацией как можно быстрее доставлен в лабораторию. Если немедленная отправка полученного образца невозможна, контейнер нужно поместить в термостат при температуре 37°С (таким образом обеспечив условия для роста микроорганизмов). Отметим, что в сопроводительной документации, которая отправляется в лабораторию, нужно указать основные клинические данные и сведения об антибактериальное терапии, если таковая проводилась (или проводится) до момента взятия образца крови.
Интерпретация результатов анализа
Большинство лабораторий при наблюдении за культурой крови обычно выдают ежедневные промежуточные заключения. Окончательный результат исследования включает точную идентификацию вида микроорганизмов, обнаруженных в культуре, а также данные о чувствительности (или устойчивости) данного вида к антибиотикам.
Результаты бактериологического посева крови делят на следующие группы:
- Рост микроорганизмов отсутствует
- Чисты рост
- Смешанный рост
Отсутствие роста микроорганизмов
Отсутствие роста бактерий в культуральной среде – нормальный результат, который означает, что кровь стерильна. Тем не менее, перед тем, как интерпретировать такой результат, необходимо убедиться, что он не является ложноотрицательным (то есть, у больного есть бактериемия, которую не удалось подтвердить лабораторно с помощью этого анализа). Основными причинами получения ложноотрицательного результата являются:
- Недостаточный объем крови, помещенный в культуральную среду
- До момента забора крови пациент принимал антибиотики
- Недостаточный инкубационный период для роста редких видом микроорганизмов, которые долго растут
Чистый рост микроорганизмов
Чистый рост микроорганизмов означает, что определяется развитие только одного вида бактерии (Escherichia coli (Кишечная палочка), Staphylococcus aureus (Золотистый стафилококк), Streptococcus pneumonia (Пневмококк) и др), обнаруженного в культуре. Если у пациента сепсис, чистый рост микроорганизмов – ожидаемый результат. Отметим, что около 10-20% случаев обнаруженная инфекция происходит не з крови пациента, а попадают в культуральную среду из-за нарушений правил асептики при заборе крови на анализ.
Отметим, что возбудителем септицемии может выступать любой вид бактерий, поэтому бывает трудно определить, является ли чистый рост бактерии в культуральной среде результатом бактериального загрязнения (ложноположительный результат) или истинно отражает септицемию (положительный результат).
Предположим, что посев крови позволил выделить, например, Staphylococcus epidermidis (Эпидермальный стафилококк), который в норме присутствует на коже каждого человека. Эта бактерия легко может попасть в культуральную среду с кожи пациента или медицинского персонала в момент забора крови. И несмотря на то, что Staphylococcus epidermidis действительно является одним из самых распространенных внешних загрязнителей культуры крови (что приводит к ложноположительному результату при посеве крови), этот кокк также выступает в роли одного из самых распространенных возбудителей септицемии у больных при инфицировании венозного катетера. Кроме этого, эпидермальный стафилококк может быть возбудителем эндокардита у пациентов после операций на сердце. То есть, обнаружение этой бактерии при посеве может означать как внешнее загрязнение, так и обладать клиническим значением.
Именно такие микроорганизмы, как эпидермальный стафилококк, входящие в состав нормальной микрофлоры человека, являются наиболее распространенными внешними загрязнителями культуры крови.
Тем не менее, чистый рост любой инфекции в культуре крови скорее всего является признаком септицемии, а не бактериального загрязнения, при условии, что этот же вид микроорганизма был выделен:
- При повторном заборе образца крови у пациента
- У пациента из любого другого инфекционного очага
Смешанный рост микроорганизмов
Получение смешанного роста означает, что в культуре крови выделяется более одного вида микроорганизмов. Истинное инфицирование крови более чем одним видом микроорганизмов происходит очень редко, поэтому такой результат, в большинстве случаев, является подтверждением загрязнения культуральной среды по причине нарушения правил асептики, особенно если выделенные изолированные виды инфекции относятся к обыкновенным контаминантам. Интерпретация такого результата анализа очень затруднительная и требует привлечения специалиста-микробиолога.
7 минут Автор: Любовь Добрецова 1738

- Показания к проведению анализа
- Возможности исследования
- Подготовительные мероприятия
- Особенности проведения процедуры
- Методика проведения БАК-посева
- Дополнительная информация
- Итоги
- Видео по теме
Анализы крови проводятся для оценки состояния здоровья организма. Обнаруженные патологические изменения биохимического состава и физических свойств крови являются основанием для диагностики болезней и выбора тактики терапии. Клиническая микроскопия располагает обширным арсеналом методов исследования основной биологической жидкости, каждый из которых изучает определенные показатели.
Кровь на стерильность, иначе БАК-посев, проверяют с целью выявления патогенных бактерий. В здоровом организме биожидкость, образованная в костном мозге (кровь), должна быть стерильна. Присутствие в кровеносной системе вредоносных микроорганизмов (бактериемия) является причиной развития бактериальных инфекций.
Заболевания инфекционно-бактериальной этиологии могут поражать органы дыхания, желудочно-кишечный тракт, кожные покровы, кровь, головной мозг. Отдельно выделяют ИППП (инфекции передающиеся половым путем) и «детские» инфекционные болезни.
Исследование включает два вида тестов:
- Биожидкость на стерильность. Выявляет наличие или отсутствие патогенных микробов.
- Кровь на гемокультуру. Определяет конкретную разновидность бактерий и степень их активности.
В ходе анализа также оценивается резистентность (устойчивость) патогенных микроорганизмов к антибактериальным препаратам. Это необходимо для выбора максимально эффективной схемы лечения инфекции, диагностированной по результатам исследования.
Показания к проведению анализа
Забор крови на стерильность не производится в рамках профилактической диспансеризации и не является обязательным при поступлении на работу (учебу). Исследование показано при определенных условиях:
- длительная субфебрильная температура (37-38 °С) тела, не сопровождаемая иными анормальными изменениями самочувствия;
- заболевания, связанные с иммунодефицитом (СПИД, ВИЧ);
- предоперационная подготовка (для оценки состояния здоровья пациента);
- постоперационный период (в качестве профилактики возможных осложнений);
- специфическая симптоматика, не поддающаяся эрадикации (ликвидации) посредством антибактериальной терапии;
- наличие имплантата в теле (искусственных клапанов миокарда и др.);
- хронический фурункулез и другие патологии, сопровождаемые гнойными инфильтратами;
- перед постановкой на длительное время внутреннего катетера и после его удаления.
Пройти исследование рекомендуется онкологическим больным после курсовой химиотерапии, поскольку такое лечение угнетает иммунную защиту организма. Анализ назначается для диагностики предполагаемых бактериальных инфекций, согласно симптоматическим жалобам пациента.
Новорожденному ребенку забор крови на стерильность проводится в следующих случаях:
- пиретическая температура (39-41°С) тела сразу после появления на свет;
- осложненная беременность (инфицирование женщины стафилококковой инфекцией в перинатальный период);
- наличие генетических аномалий, выявленных во время скрининга беременной либо после родоразрешения;
- бактериальное воспаление дна пупочной ранки у младенца (омфалит).
По необходимости оценка стерильности крови новорожденного проводится при условии преждевременного скоротечного родоразрешения.
Возможности исследования
Что показывает бактериологический посев крови на стерильность? Прежде всего, анализ выявляет само наличие бактериемии. Далее выделяется гемокультура патогенного микроорганизма. Основными возбудителями, определяемыми в ходе анализа на стерильность, являются:
- бактерии семейства кокки (стафилококки, стрептококки, гонококки, пневмококки, менингококки и т.д.);
- энтеробактерии (клебсиелла, сальмонеллы, кишечная палочка и другие);
- дрожжевые и дрожжеподобные грибы;
- палочка Коха.
Согласно разновидности бактерий, которые были обнаружены в ходе исследования, у пациента могут диагностировать:
- Менингит – инфекционно-воспалительная патология оболочек головного мозга и спинного мозга. При диплококковой разновидности заболевания патогены проникают в кровь через носоглотку, дыхательные пути, желудочно-кишечный тракт. По сосудам диплококки достигают головного мозга, что приводит к повреждению ЦНС (центральной нервной системы) и ликвора (спинномозговой жидкости). При несвоевременной диагностике инфицирование угрожает летальным исходом.
- Пиодермия – кожное воспаление, спровоцированное гноеродными кокками (стафилококками и стрептококками), проникнувшими в кровь через повреждения на коже.
- Остеомиелит – воспалительное поражение костного мозга с вовлечением костей. Носит гнойно-некротический характер, представляет опасность многочисленных осложнений опорно-двигательного аппарата. В 90% случаев возникает при инфицировании золотистым стафилококком.
- Туберкулез – инфицирование палочкой Коха. Наиболее часто встречается легочная форма заболевания. Также поражению могут быть подвержены кости, почки, мочевой пузырь, периферические лимфоузлы.
- Сепсис – смертельно опасная вторичная гнойная инфекция, вызванная грамположительными кокковыми бактериями или грамотрицательными патогенами (синегнойной и кишечной палочкой, клебсиеллой и др.). Заражение крови быстро распространяется на все органы и системы, летальность составляет от 15 до 45%.
- Эндокардит - воспаление соединительнотканной оболочки сердца, стафилококковой либо энтерококковой природы происхождения. При эмболии (переносе с кровью) инфекция может распространяться на другие органы. Типичным осложнением является сердечная и полиорганная недостаточность.
Учитывая серьезность заболеваний, вызванных бактериемией, чрезвычайно важно, своевременно определить возбудителя и начать срочное лечение.
Подготовительные мероприятия
Перед процедурой забора на бактериологический посев проводится предварительная подготовка организма, предусмотренная правилами клинико-лабораторной экспертизы. В обязанности пациента входит следующее. За 5-6 дней до планируемого анализа прервать антибактериальную и противовирусную терапию (если таковая проводится), не использовать средства гомеопатии.
За 3-5 дней исключить употребление газированных и спиртных напитков, за три дня до процедуры устранить из ежедневного меню тяжелую пищу (мясо, грибы), жирные и острые продукты, блюда, приготовленные способом жарки. Накануне Бак-посева ограничить спортивные тренировки и иные физические нагрузки, соблюдать режим голодания 8-10 часов.
Непосредственно перед сдачей крови необходимо отказаться от никотина (не курить). Пренебрежение правилами предварительной подготовки не позволит получить достоверный результат анализа. Соответственно, назначенное лечение будет ошибочным и не эффективным.
Особенности проведения процедуры
Для получения объективных данных лаборанту необходимо взять биожидкость на анализ дважды или трижды (с временным интервалом в 30 минут) из разных вен. Основным условием проведения процедуры является абсолютная стерильность. Запрещается применение катетера, в силу возможного попадания из него микроорганизмов в пробу крови.
Взятие биоматериала производится с помощью одноразового расходного материала (скарификатор, либо ланцет, шприц, перчатки), подлежащего утилизации после процедуры. Информативность и достоверность результатов исследования во многом зависит от того, насколько четко лаборант соблюдает правила забора крови:
- расходный материал вскрывается непосредственно перед его использованием;
- кожа пациента в месте предполагаемого прокола тщательно обрабатывается антисептиком;
- в шприц набирается 10 мл биологической жидкости (меньшее количество может быть непригодно для изучения);
- снятие иглы со шприца производится над горящей горелкой (это обеспечивает максимальную чистоту биоматериала), биожидкость незамедлительно перемещается в пробирку, содержащую питательную среду;
- пробирка герметично закупоривается и помещается в специализированный контейнер.
У взрослых кровь для исследования берут из вены. Для детей возможен вариант забора капиллярной крови (из пальца). У младенцев производится прокол пяточки. По показаниям, для взрослого человека предусмотрена внутривенная инъекция адреналина за 30 минут до забора крови. Зачем это нужно?
При повышении адреналинового уровня происходит сужение кровеносных сосудов брюшной полости и ускорение циркуляции крови, что вызывает мощный выброс бактерий в кровоток. Такая провокация позволяет определить максимальную концентрацию микробов.
Методика проведения БАК-посева
Исследуемые образцы помещаются в питательную среду, благоприятную для размножения и роста бактерий. Для дальнейшего изучения бактериологического состава крови используется специальная лабораторная емкость (чашка Петри).
Двухступенчатый алгоритм проведения исследования выглядит следующим образом. Первоначально в емкость с питательной средой помещают образец биоматериала и выдерживают в термостате несколько дней. При наличии патогенных микроорганизмов они начинают размножаться, образуя колонии.
В ходе исследования анализируется количество КОЕ (колониеобразующие единицы), то есть численность бактерий в одном миллилитре питательной среды. Количество колоний соответствует тяжести инфицирования. Разновидность патогена определяется зрительно (невооруженным глазом) или с помощью микроскопа.
На втором этапе определяется чувствительность к антибиотикам. Обнаруженные микроорганизмы высеиваются в лабораторную емкость, по краям которой распределяются тест-диски, пропитанные растворами разных антибиотиков. Оценка результата определяет тактику дальнейшей терапии.
Диск, не обсемененный бактериями, является образцом препарата, способного уничтожить микроорганизмы. Физическое состояние питательной среды может быть плотным или жидким. В первом случае используется твердый агар, во втором – бульон из агара.
Сколько делается анализ? Для выращивания полноценной колонии и определения резистентности возбудителей к антибиотикам требуется не менее десяти дней. Принудительно ускорить процесс нельзя, поскольку это приведет к искажению результата.
Дополнительная информация
Чтобы проверить кровь на стерильность, необходимо получить направление от врача либо сделать это самостоятельно в любом клинико-диагностическом центре Москвы и других городов. В крупных лабораториях и лабораторных службах, таких как Хеликс, Инвитро, расшифровку полученных данных можно получить на электронную почту.
Итоги
Анализ крови на стерильность является высокоинформативным исследованием для диагностики тяжелых бактериальных инфекций (менингита, туберкулеза, сепсиса, эндокардита и т.д.). Пройти процедуру необходимо при затяжном недомогании неопределенного характера, длительной гипертермии, не сопровождаемой другими симптомами, до и после хирургического вмешательства. Своевременно обнаруженная бактериемия позволит подобрать оптимальную тактику лечения, а в некоторых случаях спасти жизнь.
Биоматериал: Кровь (флакон BD Bactec Plus/F)
Срок выполнения (в лаборатории): 8-10 р.д. *
Описание
Посев крови с целью выделения гемокультуры микроорганизмов используют в клинической практике, чтобы подтвердить или исключить наличие в крови бактерий (бактериемии).
Кровь в норме стерильна (не содержит бактерий), однако повседневная жизнь связана с риском контакта циркулирующей крови с бактериями, и время от времени у здорового человека может возникать преходящая бактериемия. Например, в полости рта присутствует большое количество микроорганизмов, которые почти всегда попадают в кровоток во время или после стоматологических манипуляций. Повреждения кожи или слизистых оболочек облегчает доступ в кровоток бактерий, колонизирующих эти покровы. Несмотря на асептическую технику, многие хирургические вмешательства сопровождаются попаданием в кровь небольших количеств бактерий из мест, где они обычно представлены в изобилии. Врожденные и приобретенные механизмы иммунной защиты поддерживают стерильность крови и предупреждают переход транзиторной бактериемии в сепсис, который время от времени развивается у ряда пациентов.
Показания к назначению
Посев крови полезен в 3 клинических ситуациях:
1) при подозрении на наличие у пациента сепсиса;
2) для диагностики некоторых инфекционных заболеваний, при которых возбудители (микроорганизмы) болезни распространяются с током крови; к таким заболеваниям относятся инфекционный эндокардит (инфекция клапанов сердца), остеомиелит (инфекция костей) и инфекционный артрит (инфекция суставов); кроме того, посев проб крови показан пациентам с пневмонией средней и тяжелой степенью тяжести;
3) у лиц с лихорадкой неясного генеза; лихорадка неясного генеза определяется как повышение температуры тела в течение более 10 дней без видимой причины.
Интерпретация результатов/Информация для специалистов
При посеве крови на гемокультуру бактериологическая лаборатория обычно ежедневно выдает промежуточные заключения о наличии или отсутствии роста бактерий на питательных средах. Окончательный ответ включает идентификацию вида бактерий, выделенных из культуры, вместе со сведениями о чувствительности или устойчивости этого вида к антибиотикам.
Результаты посева крови распределяются на следующие 3 группы:
- нет роста бактерий;
- рост монокультуры (единственного вида бактерий) или чистой культуры;
- смешанный рост (выделено более одного вида бактерий).
Отсутствие роста бактерий может быть достоверным результатом, если кровь пациента действительно стерильна. Окончательный отрицательный результат лаборатория выдает, если через 10 дней после посева крови роста бактерий на культуральных средах не обнаружено. Однако следует учесть возможность того, что такой результат является ложноотрицательным, т.е. у пациента есть бактериемия, но ее не удалось выявить. Причинами ложноотрицательного результата могут быть следующие обстоятельства:
- во флакон с культуральной средой было добавлено недостаточно крови;
- до взятия крови больному было начато лечение антибиотиками (антибиотики, содержащиеся в крови взятой пробы, угнетают рост бактерий);
- инкубационный период недостаточен для получения роста редких медленно растущих видов бактерий.
При получении монокультуры или смешанного роста оценка результатов зависит от вида выделенных микроорганизмов и массивности роста.
Выделение патогенных видов бактерий с несомненностью свидетельствует об их этиологической роли в заболевании. В том случае, когда из крови выделены условно-патогенные микроорганизмы, иногда трудно решить является ли полученный вид бактерий результатом бактериального загрязнения (ложноположительный результат) или отражает наличие сепсиса (положительный результат). Выделение одного вида микроорганизмов в чистой культуре из крови более вероятно отражает наличие бактериемии, чем бактериальное загрязнение пробы, если:
- тот же вид бактерий был выделен у больного и из какого-либо другого очага инфекции;
- тот же вид бактерий был выделен при повторном взятии пробы крови;
Смешанный рост указывает на то, что из культуры крови было выделено более одного вида бактерий. При сепсисе такой результат встречается редко, поэтому в большинстве случаев свидетельствует о загрязнении культуральной среды, особенно если выделенные бактерии являются частью нормальной микрофлоры кожи.
Вместе с тем, при оценке результатов бактериологических исследований необходимо понимать, что рост микрофлоры в крови - важный диагностический признак сепсиса, но только при наличии соответствующей клинической картины заболевания.
При получении чистой культуры спектр антибактериальных препаратов, к которым определяется чувствительность, зависит от выделенного вида микроорганизмов.
В случае выделения штаммов метициллин-резистентного стафилококка дополнительно проводится определение чувствительности к антибактериальным препаратам (смотри раздел «Посев на метициллин-резистентный стафилококк и определение чувствительности к антибиотикам»).
Некоторые штаммы грамотрицательных бактерий семейства Enterobacteriacеae, высеваемых из крови, могут продуцировать бета-лактамазы расширенного спектра, т.е. относится к ESBL-штаммам, в таких случаях пациенту показано дополнительное исследование «Определение чувствительности ESBL-штаммов микроорганизмов».
Необходимо придерживаться асептической техники, чтобы исключить бактериальное загрязнение культуры. При правильном взятии проб в культуре крови присутствует только тот микроорганизм, который находится в крови пациента.
1. Кровь следует брать из периферической вены. Никогда не используйте для этого постоянный катетер, который может быть загрязнен бактериями.
2. Процедуру нужно проводить в стерильных перчатках. Место венепункции необходимо обработать 2 % раствором йода или другим антисептиком. Через 1-2 мин йод следует удалить 70 % этиловым спиртом и убедится, что кожа сухая. Крышка флаконов с культуральной средой, куда вносят образец крови, тоже должна быть продезинфицирована 70 % этиловым спиртом.
3. Кровь берут стерильным шприцем и иглой, стараясь не прикасаться руками к месту венепункции.
4. Перед введением крови из шприца во флакон с культуральной средой через закрывающую его резиновую пробку, иглу следует обязательно сменить. Это предупреждает попадание в культуру бактерий, которые могли попасть на иглу с кожи пациента. Никогда не снимайте пробку с флакона с культуральной средой. Это может привести к ее загрязнению бактериями из окружающей среды.
5. Флаконы с культурой крови должны быть снабжены этикеткой с данными о пациенте и вместе с бланком-заявкой немедленно отправлены в лабораторию. Если кровь берут, когда лаборатория закончила работу, флаконы следует поместить в термостат при температуре 37° С, чтобы мог начаться рост бактерий. В бланке-заявке на бактериологическое исследование крови важно привести клинические данные о пациенте (диагноз) и сведения о терапии антибиотиками, если она проводилась до взятия крови.
Помимо техники для успешного обнаружения специфического возбудителя сепсиса важно соблюдать определенные правила взятия проб крови для получения гемокультуры:
- многократный в течение суток бактериологический посев крови (обычно не менее 3-5 раз в сутки, кровь берут на фоне повышения температуры тела у пациента за 2-3 ч до ее максимального подъема в 2 флакона - для аэробов и анаэробов); при однократном посеве крови на гемокультуру максимально удается получить 80 % положительных результатов, при двухкратном - 90 % и трехкратном - 99 %;
- большинство методов, используемых в бактериологических лабораториях, дают положительный результат исследования гемокультуры при количестве бактерий от 10 до 15 в 1 мл крови; увеличение количества крови, взятой для исследования на гемокультуру с 2 мл до 20 мл, повышает вероятность получения положительного результата с 30 до 50 %, за исключением новорожденных;
- у детей с сепсисом количество бактерий в 1 мл крови выше, чем у взрослых, поэтому объем взятия крови рассчитывают следующим образом: у детей до 10 лет - 1 мл крови на каждый год жизни, старше 10 лет - 20 мл;
- оптимальное соотношение между количеством взятой крови для исследования и культуральной средой должно составлять 1:10;
- не следует откладывать начало лечения антибиотиками для того, чтобы получить несколько проб крови в течение большого промежутка времени (с целью повысить вероятность положительного результата исследования гемокультуры).
* На сайте указан максимально возможный срок выполнения исследования. Он отражает время выполнения исследования в лаборатории и не включает время на доставку биоматериала до лаборатории.
Приведенная информация носит справочный характер и не является публичной офертой. Для получения актуальной информации обратитесь в медицинский центр Исполнителя или call-центр.

- Показания
- Для чего проводится?
- Какие заболевания выявляются?
- Как подготовиться?
- Как проводится?
- В заключение
Анализ крови на стерильность назначают с целью выявления или исключения бактериемии, которая может быть причиной различных заболеваний. Стерильность, то есть отсутствие в крови бактерий, – нормальное состояние, которое поддерживается факторами иммунной системы. Исследование, которое еще называют бактериальным посевом крови, проводят, если есть подозрения на заболевания, связанные с проникновением в кровь болезнетворных микробов.
Показания
Посев крови на стерильность имеет несколько показаний:
- повышенная температура тела, которая держится длительное время, при этом других симптомов нет, причину такого состояния определить не удается;
- подозрение на сепсис (заражение крови);
- подозрение на инфекции (стрептококковые, стафилококковые, кишечные);
- хирургические операции;
- длительная катеризация;
- наличие искусственных клапанов сердца.
Для чего проводится?
Основная цель посева крови на стерильность – это обнаружение в ней таких болезнетворных микроорганизмов:
- золотистый стафилококк;
- синегнойная палочка;
- стрептококк;
- энтеробактерия;
- клебсиелла;
- иерсинии;
- дрожжевые грибы.
Какие заболевания выявляются?
Бак посев позволяет поставить такие диагнозы:
- менингит;
- эндокардит;
- сепсис;
- туберкулез;
- остеомиелит;
- пиодермия (гнойное заболевание кожных покровов).
Как подготовиться?
Подготовка к анализу очень проста. За два-три дня не рекомендуется есть жирное, жареное и принимать алкоголь. Последний прием пищи – не позднее, чем за 12 часов до процедуры. За несколько часов до сдачи нельзя курить.
Как проводится?
Взятие крови на стерильность проводится несколько раз за определенный промежуток времени, поскольку одноразовое исследование нельзя считать результативным. Утверждать, что возбудителем заболевания является какой-либо конкретный микроорганизм, можно только при проведении серии исследований (двух и более) и неоднократном выделении его из крови и других биологических материалов (мокроты, мочи). При этом микроорганизм должен быть обнаружен на разных питательных средах одновременно.
Забор крови проводят при максимальном повышении температуры. Брать ее нужно до того, как начнется специфическое лечение антибиотиками, в крайнем случае, не ранее чем через сутки после последнего приема.
Кровь на стерильность берут в утренние часы из вены в области локтевого сгиба. Место введения шприца тщательно обрабатывают: сначала спиртом (70%), затем йодом (1-2%). Шприц вводят после полного высыхания места укола. Для тестирования требуется 10 мл.
После того, как у больного взяли кровь, производят посев на благоприятную для роста бактерий питательную среду и выдерживают несколько суток при температуре 37-38°C в термостате.
По истечении времени в результате роста бактерий на поверхности появляются колонии, которые видны невооруженным глазом. По их виду лаборант может определить вид микроорганизма. Выявленную бактерию сеют в чашку Петри. По ее окружности кладут смоченные в разных антибиотиках диски из бумаги. Чашка Петри помещается на несколько суток в термостат, где вырастают новые колонии. Эффективным будет тот препарат, вокруг диска с которым роста бактерий не наблюдается, что говорит о гибели микробов или невозможности их развития.
Сегодня применяют два способа посева:
- на среду для определения чувствительности к основным антибиотикам;
- на среду для выявления чувствительности к широкому спектру препаратов.
Первые результаты получают через трое суток. Для получения окончательного результата может потребоваться от 10-ти до 14-ти дней.
Анализ можно сдать в любом медицинском учреждении, где есть лаборатория. Компания «Инвитро» – одна из крупнейших независимых лабораторий, предлагающих свои услуги во многих городах России. Сеть «Инвитро» работает около 20-ти лет. Здесь можно пройти любое исследование крови, в том числе тест на стерильность.
В заключение
Этот тест проводится достаточно редко. Сдавать кровь на бактериемию приходится в том случае, если другими способами не удалось определить возбудителя инфекции. Этот анализ дает возможность точно определить вид микроорганизма, а также показывает стадию болезни.
Читайте также:







