Глицерин фуксиновый бульон штерна определение
1. Фуксиновый Андреде. 0,5 кислого фуксина растворяют в 100 мл воды и обесцвечивают 4-проц. раствором едкого натра (около 16,0). Стерилизуют 15 мин. при 110°.
2. Лакмусовый. Лакмус обливают 10-кратным количеством спирта и настаивают 3 дня. Спирт меняют ежедневно. Разводят в 6—8 раз дестиллированной водой. Через 3 дня фильтруют, дробно стерилизуют по 15 мин. и получают лакмусовую настойку.
3. Лакмусовое молоко. К обыкновенной молочной среде добавляют 2—3 капли лакмусовой настойки.
Среда с рамнозой (Биттера). Берут 100 мл дестиллированной воды; 0,05 двуметаллического фосфорнокислого натрия (HPO4); 0,1 сернокислого аммония; 0,2 лимоннокислого натрия (трехосновного); 0,5 поваренной соли; 0,01 пептона; 0,5 рамнозы. Все растворяют при кипячении, фильтруют и стерилизуют в аппарате Коха 3 дня по 30 мин. Среда готова.
К 16-часовой культуре микроба в этой среде добавляют 2 капли -0,5-проц. алкогольного раствора желтой краски метилрот.
Глицерин-фуксин-бульон (Штерна). Берут 100,0 МПБ (рН 7,8); 5—6 капель насыщенного спиртового раствора основного фуксина; 2,0 мл 10-проц. водного раствора свежеприготовленного сернистокислого натрия (Na2S03); 0,5—1 мл 0,25-проц. водного раствора хризоидина (до слаборозового окрашивания); 1,0 глицерина. Разливают по пробиркам и стерилизуют.
Нейтральрот-агар (Ротбергера). К 200,0 МПА добавляют 3,0 глюкозы; 0,3 насыщенного водного раствора нейтральрот. Хорошо смешивают, разливают по пробиркам, стерилизуют и остуживают столбиком.
Среда розоватокрасная. Посев уколом. Стерилизация сред производится или в аппарате Коха 3 дня по полчаса (с оставлением сред в продолжение трех дней в аппарате) или в автоклаве в течение 20 мин. при 120° или 1 атм. давления сверх наружного атмосферного давления.
Однако в автоклаве при 120° можно стерилизовать только МПА и МПБ.
Картофель и желатину стерилизуют при температуре, не превышающей 112° при давлении 0,5 атм., а молоко и среды, содержащие различные углеводы (сахара), — при температуре, не превышающей 105°, при давлений 0,2 атм. Соответственно понижению температуры при стерилизации повышается продолжительность стерилизации.
Изоляция микробов. Изолирование микробов из тканей и органов больных или павших животных производят на плотной среде, обычно МПА. Наиболее употребительны — способ фракционированных посевов и способ разливов в чашки Петри.
Посевы на пестрый ряд проводятся с целью изучения биохимической активности микробов с сахарами, белками и красителями. Наиболее часто используют "узкий" пестрый ряд:
1. Простое молоко;
2. Лакмусовое молоко;
3. Среда Гисса с лактозой;
4. Среда Гисса с глюкозой;
5. Бульон Штерна.
Простое молоко – обезжиренное, pH – 7,2. Применяется для изучения протеологических ферментов.
Бактерии группы кишечная палочка свертывают молоко, а сальмонеллы не свертывают.
Лакмусовое молоко▬к обезжиренному молоку добавляют 5-10% лакмусовой настойки, молоко приобретает синевато-фиолетовую окраску. Применяется для изучения редуцирующих свойств.
Кишечная палочка образует кислоту, лакмусовое молоко становится розово-красным.
Сальмонеллы не вызывают изменения.
Среда Гисса с лактозой и глюкозой pH (7,4) –Состав:
1. Вода дистиллированная – 100 мл;
2. Пептон 2 – 1 гр.;
3. Хлорид натрия – 0,5 гр.;
4. Индикатор Андредэ – 1 гр.;
5. Глюкоза или лактоза – 1 гр.
Применяют эти среды для изучения способности микробов ферментировать глюкозу или лактозу.
Кишечная палочка – ферментирует глюкозу и лактозу с образованием кислоты и газа.
Сальмонеллы – ферментируют глюкозу с образованием кислоты и не ферментируют лактозу.
Среда Штерна применяется для дифференциации
сальмонелл и состоит из:
2. Р-р фуксина основного – 5 капель;
3. 10% р-р сульфита натрия – 2 мл;
4. Глицерин – 2 мл;
5. 0,25% р-р хризоидина – 1 мл.
Сальмонеллы S. typhimurium дают на среде покраснение. Кишечная палочка – среду не меняет.
Сальмонеллы - аэробы и факультативные анаэробы оптимальная температура роста 37 0 С, рН среды 7,0-7,2, однако они могут расти и при рН ниже 7,0 до 8,0 и выше. Хорошо растут на обычных питательных средах: МПА, МПБ, средах Эндо, Левина, Плоскирева, висмут-сульфитном агаре и др.
На мясопептонном агаре растут в виде полупросвечивающих, в большинстве случаев круглых колоний; на мясопептонном бульоне образуют равномерное помутнение; желатины не разжижают; индола не образуют; ферментируют глюкозу с образованием кислоты и не ферментируют лактозу.
Антигенная структура сальмонелл представлена соматическим или О-антигеном, жгутиковым или Н-антигеном.
Бактерии группы кишечная палочка (БГКП)являются аэробамиили факультативными анаэробами, оптимальная температура роста 37-38 0 С, рН среды 7,0-7,4. Хорошо растет на обычны питательных средах – МПА, МПБ, средах Эндо и Левина. На МПА через 24 ч появляются сочные, круглые, с ровными краями и гладкой поверхностью (S- форма) серо-белого цвета колонии. В МПБ – интенсивное помутнение среды и наличие незначительного осадка, легко разбивающегося при встряхивании
Бактерии группы кишечной палочки имеют сложное строение антигена. Они имеют три различных антигена О-(соматический), Н-(жгутиковый) и К-(капсульный). Среди всей этой группы встречаются патогенные серотипы, условно-патогенные и даже полезные для человека (ацидофильная, болгарская бактерии, актиномицеты и др.).
Биохимически кишечные палочки очень активны. Все они расщепляют лактозу, глюкозу, маннит, мальтозу, декстрозу, галактозу и ксилозу, разжижают желатин, редуцируют нитраты в нитриты, подавляющее большинство образуют индол, но не разлагают инозита и не образуют сероводород.
Бактерии группы протея также имеют различную антигенную структуру, которая положена в основу типизации и диагностики.
На основании ряда культурально-биохимических признаков описаны такие виды протея, как Proteus vulgaris, Proteus mirabilis и др. Эти бактерии обладают большой изменчивостью признаков, что затрудняет их классификацию. Наиболее постоянный признак для всех видов протея – способность разлагать мочевину.
Все условно-патогенные бактерии обладают относительно высокой устойчивостью. На объектах внешней среды сохраняются от 10 дней до 6 мес., устойчивы к высоким концентрациям поваренной соли и к высыханию, не погибают при минусовых температурах, жизнеспособны в холодной воде.
Быстро погибают при температуре +68° С и выше.
3.4. Исследование бактерий на подвижность.
Определение подвижности проводят методом "раздавленной" или "висячей капли".
Метод "раздавленной капли".
Готовится предметное стекло с луночкой, фломбируется, края лунки смазываются вазелином. На покровное стекло наносится капелька бульонной культуры, переворачивается на лунку так, чтобы не было соприкосновения с краями лунки (капля висит). Подогревается и микроскопируется.
Для контраста бульонную культуру предварительно окрашивают 1% раствором метиленового голубого.
3.5. Реакция агглютинации с монорецепторными сальмонеллезными, сыворотками.
Реакция основана на выделении О-(соматических) и Н-(жгутиковых) антигенов у отдельных видов сальмонелл при использовании монорецепторных сывороток.
В ветеринарной практике можно обнаружить главным образом бактерии рода сальмонелл пяти подгрупп: В, С1, С2, Д1, Е1.. Первоначально культуры испытывают в реакции агглютинации на предметном стекле с поливалентной сывороткой, с целью установления рода бактерий.
При отрицательной реакции дальнейшее исследование с О и Н агглютинирующими сыворотками не проводят.
При положительной реакции с поливалентной сывороткой приступают к их видовой дифференциации при помощи монорецепторных Если положительная реакция с одной из групповых сывороток указывает на принадлежность выделяемых культур к роду сальмонелл к той или иной серологической группе, то реакция агглютинации с монорецепторными сыворотками позволяет типизировать представителей этих бактерий до вида.
Техника постановки реакции агглютинации.
На предметное стекло наносят одну каплю неразведенной сыворотки. Платиновой петлей берут испытуемую 20 часовую агаровую культуру (для агглютинации с поливалентной и О сыворотками с верхней части агара, а для агглютинации Н сыворотками - из нижней).
Петлю с культурой постепенно смешивают с каплей и растирают на стекле.
"О"-агглютинация (образование комочков) наступает медленно.
"Н"-агглютинация наступает быстрее, агглютинат имеет вид крупных, легко разбивающихся хлопьев.
Агглютинат с поливалентной сывороткой имеет смешанный характер (хлопья, зерна). Реакция отрицательная – гомогенная взвесь.
Идентификацию сальмонеллезных культур проводят в следующем порядке. Сначала культуру испытывают в РА с одной из О сывороток, выбор которой основывается на виде животного, от которого выделена исходная культура и предполагаемого часто встречающегося серотипа.
При отрицательной реакции испытывают в РА с остальными четырьмя групповыми "О"-сыворотками.
При положительной реакции относят культуру к одной из подгрупп, Затем культуру испытывают в РА с Н-сыворотками первой и второй фазы. На основе положительной РА с определенными "О"- и "Н"-сыворотками испытуемую культуру относят к одному из серотипов.
3.6. Биологическая проба.
Цель биологической пробы – воспроизвести лабораторную модель болезни, выделить чистый возбудитель, определить его степень патогенности и подтвердить диагноз.
В качестве лабораторных животных используют белых мышей, морских свинок и кроликов.
Их заражают подкожно, внутрикожно, внутрибрюшинно, в мозг, внутривенно. Материалом для заражения служит суспензия из патологического материала.
На основе исследования свойств микроорганизмов определили их видовую принадлежность /53/. Бактерии рода Listeria представляют собой короткие палочки правильной формы с закругленными краями. Грамположительные, неспорообразующие, каталазоположительные. Следовательно, культуры 3, 7, G, I’ можно отнести к данному роду, т. к. они имели форму коротких палочек, окрасились в фиолетовый цвет (грамположительные) и не образовывали при определении каталазы «пенистую шапку». Данные микроорганизмы широко распространены в окружающей среде, некоторые виды патогенны для человека и животных.
Культуру F можно отнести к роду Brochotrix. Данные микроорганизмы имеют палочки правильной формы в цепочках, грамположительные и каталазоположительные. Эти признаки наблюдались при изучении свойств культуры F. Данные организмы широко распространены в природе.
Бактерии рода Bacillus имеют форму прямых палочек с закругленными концами, грамположительные, подвижные и образующие овальные эндоспоры, каталазоположительные. Как видно из данных табл. 4, все эти признаки относятся к культуре I. Данные микроорганизмы обнаруживаются в разнообразных местообитаниях, некоторые виды патогенны для позвоночных и беспозвоночных.
Липолитические свойства микроорганизмов определяли посевом в бульон Штерна, где в качестве единственного источника углерода использовали оливковое масло с концентрацией 1 см3/100 см3 бульона. Бактерии, обладающие липолитическими свойствами, при ферментации оливкового масла извлекают из него альдегиды, подкисляя среду, при этом окраска бульона переходит из золотисто-желтой в розовую. Стерильный бульон Штерна разливали в пробирки по 10 см3 в каждую и вносили исследуемые культуры. Пробирки с микроорганизмами термостатировали при температуре (38±0,5)0С. В течение 120 ч проводили визуальные наблюдения за изменением физических свойств бульона Штерна, которые выражались в образовании хлопьев, а также в изменении цвета и прозрачности. В качестве контрольного варианта использовали состав, включающий в себя бульон Штерна без введения микроорганизмов. Результаты наблюдений представлены в табл. 5.
Таблица 5. Влияние типов бактерий на свойства бульона Штерна
| ← Глицерин, в технике | Глицерин Энциклопедический словарь Брокгауза и Ефрона | Глицерины → |
 Словник: Германия — Го. Источник: т. VIIIa (1893): Германия — Го, с. 888—890 ( скан · индекс ) • Другие источники: МЭСБЕ : ТСД |
Глицерин (способ определения). Г. открывается легко только в водных растворах. Качественными реакциями на него служат: характерный запах акролеина, образующегося при выпаривании досуха раствора с кислым сернокислым кали и нагревании затем остатка (выделяющиеся газы можно собрать в воде и доказать образование акролеина помощью фуксино-сернистой кислоты [1] ; появление зеленого цвета при внесении в пламя горелки кусочка буры, смоченного раствором Г. (предварительно должно быть доказано отсутствие аммиачных солей, или же они должны быть удалены) и карминово-красное окрашивание при прибавлении аммиака к охлажденному раствору Г., нагретому ранее до 120° с серной кислотой (Рейхль). Количественное содержание Г. в водных растворах можно вычислить на основании удельного веса или показателя преломления раствора (числовые данные см. ниже); но для этого необходимо, чтобы раствор был заведомо чист [2] . Из методов определения содержания Г. в продажных образцах его отметим следующие: Шампион и Пелле определяют Г. в виде нитроглицерина, для чего вещество обрабатывают смесью концентрированных азотной и серной кислот (Дикман советует прибавлять при охлаждении по каплям смесь 5 ч. серной кислоты в 66°Б с 3 ч. азотной кислоты в 48°Б.; серная и азотная кислоты не должны содержать соляной кислоты и в азотной кислоте может быть не более 1 % азотистой кислоты); образовавшийся нитроглицерин промывают водой, растворившуюся в промывных водах часть извлекают эфиром, сушат до постоянного веса на водяной бане и взвешивают; 190 ч. нитроглицерина отвечают 100 ч. Г. Безопаснее способ Моравского, состоящий в том, что 1 ч. сырого Г. смешивают с 25 ч. окиси свинца, выпаривают и сушат до постоянного веса при 130°. Привес окиси свинца отвечает всем нелетучим примесям, содержавшимся в Г., и его остатку С3Н6О2; количество нелетучих примесей определяют (приблизительно) высушиванием навески Г. до постоянного веса при 160° (Г. при этой температуре довольно быстро испаряется), вычитают из привеса окиси свинца и разность умножают на 1,3429. Способ удобный, но применимость его ограниченная, так как он дает хорошие результаты только с довольно чистыми образцами Г., содержащими кроме хлористого натрия лишь незначительные количества посторонних органических веществ; когда же имеется подмесь сернокислых солей, свободных щелочей или смолистых веществ, то не удается вполне удалить Г. нагреванием при 160° и, кроме того, невозможно (без более сложных приборов) избежать поглощения углекислоты едкими щелочами (Генер). По Бенедикту и Кантору, кипятят (в продолжение 1 часа) Г. (1 г) с уксусным ангидридом (7 г) и безводной уксусно-натровой солью (3 г) в колбе с обратно поставленным холодильником (иначе происходит потери вследствие значительной летучести триацетина с парами воды); затем раствор охлаждают; прибавляют 50 куб. см воды; слегка подогревают, чтобы облегчить растворение осевшего масла; отфильтровывают от белого хлопьевидного осадка, который содержит большую часть органических примесей Г. и может быть очень значительным; снова охлаждают; усредняют в присутствии фенолфталеина уксусную кислоту слабым раствором едкого натра, избегая его избытка; омыляют триацетин раствором едкого натра (приблизительно 10 %) и титруют обратно его избыток нормальной соляной кислотой, которой точно определяют и титр едкого натра, употребленного для омыления; разность обоях титрований представляет количество соляной кислоты, пошедшей на омыление триацетина; 1 куб. см нормальной соляной кислоты отвечает 0,03067 г Г. Вследствие легкой омыляемости триацетина, даже при строгом соблюдении приведенных условий, получаются по этому способу большей частью слишком низкие цифры; он совершенно неприменим, если исследуемый раствор содержит менее 30 % Г. (Генер). Вполне по принципу аналогичен более простой способ Баумана-Дица, состоящий в том, что раствор Г. (около 0,1 г Г. в 10—20 куб. см воды) взбалтывается 10 — 15 минут с хлористым бензоилом (5 куб. см) и едким натром (35 куб. см 10 % раствора), выделяющийся осадок растирается со щелочной жидкостью (для полноты удаления хлористого бензоила) и, после кратковременного стояния, собирается на высушенном при 100°C фильтре, промывается водою и, наконец, сушится 2—3 часа при 100°C 3,85 ч. полученной смеси ди- и трибензоата [3] . отвечают 1 ч. Г. Другие многоатомные спирты и углеводы, способные также с хлористым бензоилом давать сложные эфиры, должны отсутствовать, или же их необходимо предварительно удалить [4] . Это особенно важно при определении содержания Г. в пиве и вине, где поступают следующим образом: 50 куб. см пива выпаривают досуха с примесью песка и известкового молока; остаток мелко растирают, извлекают 50 куб. см 96 % спирта, к охлажденной вытяжке прибавляют 75 куб. см абсолютного эфира, который осаждает мальтозу и парапептон; фильтрат выпаривают на водяной бане; остаток сушат при 100°—150° C, растворяют в 5—10 куб. см воды и взбалтывают с 2—3 куб. см хлористого бензоила и 7 ч. 10 % едкого натра; затем поступают по вышеуказанному. Точно так же анализируются и вина, с той лишь разницей, что при перебродивших, бедных сахаром белых и красных винах выпаривают с известковым молоком 20 куб. см вина, остаток извлекают 20 куб. см 96 % спирта, по осаждении прибавляют 30 куб. см безводного эфира, фильтруют, осадок промывают смесью спирта (2 ч.) с эфиром (3 ч.) и фильтрат выпаривают на водяной бане, а при сладких винах к 20 куб. см вина кроме известкового молока прибавляют еще 1 г песка, а количества спирта и эфира удваивают; для окончательного определения берут не более 0,1—0,2 г сырого Г., выделенного таким образом. При определении содержания Г. в жирах к 100 ч. расплавленного жира прибавляют 65 ч. кристаллического гидрата окиси бария; массу старательно растирают; прибавляют для облегчения омыления еще 80 куб. см 95 % спирта; затем, когда все затвердеет, кипятят (в продолжение 1 ч.) с 1 литром воды; растертый осадок баритовых солей промывают еще раза два водой; все водяные вытяжки подкисляют серной кислотой, выпаривают на половину; избыток серной кислоты удаляют углекислым баритом; фильтрат сгущают до 50 куб. см и окончательно содержание в нем Г. устанавливают одним из описанных выше способов.
Удельный вес водных растворов глицерина. Чистый Г. в жидком виде при обыкновенной температуре представляет густую, сиропообразную жидкость, очень мало изменяющую свои внешние свойства от прибавки воды. Но так как от прибавления воды уд. вес уменьшается, то содержание Г. в растворе проще всего (когда нет иных подмесей) определяется с помощью удельного веса [5] . Определения, сделанные мной в 1861 г. для безводного глицерина, согласуются с позднейшими более подробными исследованиями В. Ленца (1880) и Герлаха (1884) и в результате [6] получается следующая таблица, в которой p означает содержание Г. в процентах по весу, s есть удельный вес при 15 °C, считая воду при 4° за 10000 [7] , ds/dp есть изменение (производная) уд. веса при возрастании содержания Г. на 1 % и ds/dt есть изменение уд. веса при возрастании температуры на 1°C.
| р = | 0 % | s = | 9992 | ds/dp = | 23,6 | ds/dt = | −1,5 |
| 10 % | 10233 | 24,5 | −2,0 | ||||
| 20 % | 10473 | 25,3 | −2,2 | ||||
| 30 % | 10739 | 26,2 | −2,8 | ||||
| 40 % | 11005 | 27,0 | −3,5 | ||||
| 50 % | 11279 | 27,8 | −4,1 | ||||
| 60 % | 11562 | 28,7 | −4,6 | ||||
| 70 % | 11845 | 27,8 | −5,2 | ||||
| 80 % | 12118 | 26,9 | −5,4 | ||||
| 90 % | 12382 | 25,9 | −5,7 | ||||
| 100 % | 12637 | 25,0 | −5,7 |
Данные для уд. веса выражаются с достаточной для практики точностью двумя параболами:
| От | р = 0 0 % | до | р = 0 63 % | : | S = 9992 + 23,65р + 0,0420р 2 |
| » | р = 63 % | » | p = 100 % | S = 9671 + 34,33p − 0,0467р 2 |
Промежуточное же соединение (р = 63,0 % Г.) отвечает составу C 3H3O3 + 3H2O.
Бактерии группы Salmonella обладают избирательными сахаролитическими свойствами, кроме того, выделяют сероводород, а отдельные штаммы способны разжижать желатин.
Бактерии группы Е. coli обладают преимущественно сахаролитическими свойствами, поэтому при росте на элективных средах, трехсахарном агаре и средах Гиса они расщепляют сахара, вызывая смещения рН среды в кислую сторону, что приводит к изменению цветаиндикатора.
Бактерии группы Proteus активно размножаются во внешней среде и продуктах питания при рН от 3,5 до 12, выдерживают нагревание до 65°С в течение 30 мин, характеризуются устойчивостью к поваренной соли и высыханию. Бактерии группы Proteus на агаре и большинстве твердых сред растут «ползучим» ростом, расщепляют желатин, ферментируют мочевину, выделяют протеолитические ферменты, некоторые штаммы выделяют сероводород, фенол, аммиак и индол, большинство -сахаров не расщепляют. Основные биохимические свойства возбудителей пищевых токсикоинфекции представлены в табл. 11.
Биохимические свойства возбудителей пищевых токсикоинфекций
| Вещество | Сальмонелла | Кишечная палочка | Протей |
| Глюкоза | + | + | + |
| Лактоза | - | -/+ | - |
| Сахароза | - | -/+ | - |
| Маннит | + | + | - |
| Мочевина | - | - | + |
| Сероводород | + | - | -/+ |
| Индол | - | + | -/+ |
| Разжижение желатина | -/+ | - | + |
Для изучения культуральных и биохимических свойств возбудителей пищевых токсикоинфекции вторичные посевы делают на трехсахарный агар и среды короткого пестрого ряда.
Трехсахарный агар с индикатором «ВР» (Крумвиде-Олькеницкого в модификации Ковальчука)
В 1000 мл дистиллированной воды растворяют 2 г глюкозы* 1| г сахарозы, IS г лактозы, 0,6 г соли Мора, I г серноаатистокислого натрия и
10 г мочевины. Соль Мора и серноватистокислый натрий предварительно растворяют в 5-7 мл дистиллированной воды в пробирках. Углеводы и мочевину также растворяют в 10 мл дистиллированной воды в колбе на водяной бане. До стерилизации устанавливают рН 7,4-7,6 и добавляют 46 г сухой среды с сахарозой и индикатором «ВР» (смесь розоловой кислоты и метиле нового синего в равных пропорциях). Раствор размешивают и кипятят до расплавления агара, разливают в пробирки по 5—6 мл в каждую. Среду, разлитую в пробирки, стерилизуют текучим паром 2 дня по 30 мин или при температуре 112° С в течение 20 мин. После стерилизации среду скашивают так, чтобы остался небольшой столбик (не менее 3 см). Среда янтарного цвета с красноватым оттенком.
Трехсахарный агар с мочевиной (по Олькеницкому)
К 100 мл стерильного питательного агара добавляют 1 г лактозы, 0,02 г соли Мора, 0,03 г гипосульфита натрия, 1 г сахарозы, 0,1 г глюкозы, 1 г мочевины и 1 мл 0,4 % раствора фенолового красного.
Предварительно растворяют соль Мора с гипосульфитом в одной пробирке с небольшим количеством воды, а в другой — мочевину с углеводами. После растворения все смешивают с агаром и фильтруют через стерильную марлю. Разливают по пробиркам по 5—6 мл. Стерилизуют текучим паром 3 дня подряд по 20 мин. Среда имеет бледно-розовый цвет.
Методика посева возбудителей
пищевых токсикоинфекции на трехсахарный агар
Готовят взвесь микробных клеток в изотоническом 0,9 % растворе хлористого натрия с концентрацией 2—3 млн микробных клеток. Для этого берут пробирку с 5 мл стерильного изотонического раствора и вносят в нее профламбированной петлей кусочек исследуемой колонии микроорганизмов и тщательно перемешивают. Эту процедуру повторяют до тех пор, пока жидкость в пробирке не станет опалесцировать. Затем распрямляют бактериологическую петлю, опускают ее в приготовленную взвесь и делают увкол на всю глубину трехсахарного агара. Затем бактериологическую петлю флам-бируют, остужают, повторно опускают во взвесь бактерий и делают посев штрихом на скосе.
Учет роста возбудителей пищевых токсикоинфекции на трехсахарном агаре
После инкубации при температуре 37°С в течение 24 часов проводят учет роста возбудителей (см. табл. 12,13).
Таблица 12. Рост возбудителей пищевых токсикоинфекции на трехсахарном агаре с индикатором «ВР»
| Микроорганизм | Изменение среды | |
| Salmonella | Столбик среды обесцвечивается и становится ж ла вследствие выделения сероводорода образую с черной окантовкой, скос остается янтарного i | елтым, вокруг вко-тся разрывы среды хвета |
| Е. coli | Вследствие расщепления всех Сахаров рН средь л ой, и среда приобретает синий цвет | i становится ос- |
| Proteus | Вследствие расщепления мочевины рН среды с ной, и среда приобретает шафранно-красный i | тановится шел оч-1вет и чернеет |
Таблица 13. Рост возбудителей пищевых токсикоинфекции на трехсахарном агаре (по Олькеницкому)
На основе исследования свойств микроорганизмов определили их видовую принадлежность /53/. Бактерии рода Listeria представляют собой короткие палочки правильной формы с закругленными краями. Грамположительные, неспорообразующие, каталазоположительные. Следовательно, культуры 3, 7, G, I’ можно отнести к данному роду, т. к. они имели форму коротких палочек, окрасились в фиолетовый цвет (грамположительные) и не образовывали при определении каталазы «пенистую шапку». Данные микроорганизмы широко распространены в окружающей среде, некоторые виды патогенны для человека и животных.
Культуру F можно отнести к роду Brochotrix. Данные микроорганизмы имеют палочки правильной формы в цепочках, грамположительные и каталазоположительные. Эти признаки наблюдались при изучении свойств культуры F. Данные организмы широко распространены в природе.
Бактерии рода Bacillus имеют форму прямых палочек с закругленными концами, грамположительные, подвижные и образующие овальные эндоспоры, каталазоположительные. Как видно из данных табл. 4, все эти признаки относятся к культуре I. Данные микроорганизмы обнаруживаются в разнообразных местообитаниях, некоторые виды патогенны для позвоночных и беспозвоночных.
Липолитические свойства микроорганизмов определяли посевом в бульон Штерна, где в качестве единственного источника углерода использовали оливковое масло с концентрацией 1 см3/100 см3 бульона. Бактерии, обладающие липолитическими свойствами, при ферментации оливкового масла извлекают из него альдегиды, подкисляя среду, при этом окраска бульона переходит из золотисто-желтой в розовую. Стерильный бульон Штерна разливали в пробирки по 10 см3 в каждую и вносили исследуемые культуры. Пробирки с микроорганизмами термостатировали при температуре (38±0,5)0С. В течение 120 ч проводили визуальные наблюдения за изменением физических свойств бульона Штерна, которые выражались в образовании хлопьев, а также в изменении цвета и прозрачности. В качестве контрольного варианта использовали состав, включающий в себя бульон Штерна без введения микроорганизмов. Результаты наблюдений представлены в табл. 5.
Таблица 5. Влияние типов бактерий на свойства бульона Штерна
Короткий пестрый ряд используется для изучения биохимических свойств возбудителей пищевых токсикоинфекций и определения рода бактерий. Короткий пестрый ряд представляет собой набор сред, разлитых в пробирки: скошенный МПА, бульон Хоттингера, МПЖ, среды Гисса с сахарами (лактоза, глюкоза, сахароза и маннит). В бульон Хоттингера под пробку помещают индикаторную бумажку, пропитанную уксуснокислым свинцом (для определения сероводорода), а в среду Гисса с глюкозой помещают газовичок для определения углекислого газа.
Длинный пестрый ряд используется для типизации возбудителей пищевых токсикоинфекиий. Длинный пестрый ряд состоит из сред короткого пестрого ряда и дополнительных сред Гисса со следующими сахарами: арабинозой, дульцитом, инозитом, рамнозой, «бульоном Штерна», трегалозой, ксилозой и др.
Бульон Хоттингера. К 100 мл основного раствора Хоттингера (мясной бульон 1:2, гидролизованный панкреатином) добавляют 500 мл водопроводной воды, 3 г хлорида натрия и 0,12 г двузамещенного фосфорнокислого калия. Полученный раствор кипятят в течение 10 мин, фильтруют, устанавливают pH 7,2-7,4 и стерилизуют в течение 20 мин при температуре 120 °С. Бульон Хоттингера используется для определения сероводорода и индола. После посева под пробкой закрепляют индикаторные бумажки на сероводород и индол.
Приготовление индикаторной бумаги для определения сероводорода. В 100 мл дистиллированной воды растворяют 20 г уксуснокислого свинца и 1 г двууглекислого натрия. Этим раствором пропитывают полоски фильтровальной бумаги, высушивают их при температуре 18-23 °С и нарезают на узкие полоски. После приготовления бумага остается белой. При наличии сероводорода — буреет и чернеет.
Приготовление реактива Эрлиха. 5 г парадиметиламидобензальдегида, 10 мл очищенной концентрированной фосфорной кислоты растворяют в 50 мл 96%-ного спирта и пропитывают им индикаторную бумажку. При положительной реакции на индол бумажка розовеет. Для определения индола вместо индикаторной бумажки можно провести реакцию с реактивом Эрлиха в пробирке. В пробирку с бульоном Хоттингера добавляют 2—3 мл эфира и 1 мл реактива Эрлиха. При этом реактив Эрлиха и индол скапливаются на границе эфира и бульона и, вступая в реакцию, образуют кольцо розового цвета.
Пептонно-углеводные среды (среды Гисса). К 100 мл дистиллированной воды прибавляют 1 г сухого ферментативного пептона, 0,5 г хлористого натрия и нагревают до растворения, затем фильтруют до тех пор, пока раствор не станет совершенно прозрачным. Устанавливают pH 7,0, прибавляют 0,5 г углевода и 1 мл индикатора Андреде. Среду разливают по 5 мл в пробирки с поплавками и стерилизуют 20 мин при температуре 100 °С. Среда должна быть бесцветной или соломенно-желтого цвета без розового оттенка. Можно использовать готовые среды Гисса. Для приготовления индикатора Андреде к 100 мл дистиллированной воды добавляют 16,4 мл 1 н раствора гидроокиси натрия и 0,5 г кислого фуксина. Раствор стерилизуют 5 мин при температуре 110-112 “С. Индикатор хранят в склянке из темного стекла.
Бульон Штерна. К 100 мл мясопептонного бульона добавляют 5 капель насыщенного спиртового раствора основного фуксина, 1 мл глицерина и 2 мл свежеприготовленного 10%-ного раствора сернокислого натрия. Среду разливают по пробиркам, стерилизуют при температуре 110 °С 10—15 мин. Среда — золотисто-желтого цвета.
Методика посева на среды короткого и длинного пестрого ряда. Посев на среды короткого и длинного пестрого ряда проводят взвесью микробных клеток (приготовление взвеси см. выше — посев на трехсахарный агар). Для посева на скошеннный МПА бактериологическую петлю фламбируют, остужают, опускают во взвесь бактерий и делают посев штрихом на скосе. На все остальные среды посев делают при помощи пастеровской пипетки. Запаянный конец стерильной пастеровской пипетки обламывают над пламенем газовой горелки, после чего пипетку заполняют взвесью микробных клеток. Пробирку со средой осторожно приоткрывают над пламенем газовой горелки и капают в нее каплю взвеси, после чего пробирку быстро закрывают. После посева конец пастеровской пипетки запаивают над пламенем газовой горелки, а саму пипетку помещают в емкость с дезинфекционным раствором. Штатив со средами короткого или длинного пестрого ряда помещают на 24 ч в термостат с температурой 37 °С.
Чистота
1. Прозрачность и цветность водного и спиртового растворов -должны быть прозрачными и бесцветными.
2. Примесь минеральных кислот (используются при получении кислоты борной). При добавлении к водному извлечению из лекарственного вещества индикатора метилового оранжевого не должно быть розового окрашивания. Сама борная кислота, как очень слабая, не дает розового окрашивания с этим индикатором.
3. допускаются, в пределах эталона общие примеси: хлориды, сульфаты, железо, тяжелые металлы (CI, SO4, Fe, Ca, As).
1 Метод алкалиметрии вариант нейтрализации в присутствии глицерина (нейтрализованного по фенолфталеину). Метод основан на кислотных свойствах кислоты глицеринборной. Глицероборная кислота титруется NaОН по индикатору фенолфталеину как одноосновная кислота.
· Воду для растворения борной кислоты берут прокипяченную для удаления углекислого газа (СО2).
· Глицерин – нейтрализуют по ф/ф.
·
 |
Титрование ведут при комнатной температуре, т.к. при Т=50°С комплекс борной кислоты с глицерином разрушается.
Среда глицерина определяется факторами:
1) водные растворы борной кислоты имеют слабокислую реакцию. При титровании щелочью будет находится при рН = 11, подобрать индикатор, который дал бы при этом рН резкий переход окраски трудно;
2) борная кислота при действии щелочей образует соли не борной, а тетраборной (H2B4O7) и метаборной (HBO2) кислот. Соли метаборной кислоты сильно гидролизуются:
Н3ВО3+ NaОН → Na2B4O7
Н3ВО3 + NaОН → NaBO2
NaBO2 + 2 H2O → Н3ВО3 + NaОН
Т.е. индикатор зафиксирует щелочную реакцию среды раньше т.э., непосредственное титрование Н3ВО3 щелочью невозможно.
3) Усилить кислотные свойства борной кислоты, можно используя способность ее образовывать с многоатомными спиртами (глицерин, манит, сорбит) комплексные соединения с более сильными кислотными свойствами.
Состав и свойства глицероборатного комплекса наиболее изучен, поэтому при титровании борной кислоты предлагают глицерин.

Образующаяся глицеринборная кислота и титруется NaОН по индикатору фенол – фталеину как одноосновная кислота.

4) Образующаяся при титровании натриевая соль кислоты глицеринборной частично может гидролизоваться и розовое окрашивание по фенолфталеину может появиться раньше точки эквивалентности. Поэтому в конце титрования, когда появилось розовое окрашивание, вновь добавляют глицерин. Если окрашивание исчезает, то продолжают титрование, в т.э. снова добавляют порцию глицерина и т.д. до того момента, когда при добавлении глицерина розовая окраска не будет исчезать. Это говорит о том, что изменение окраски индикатора вызвано избытком щелочи, а не гидролизом.
2.Комплексонометрия – обратное титрование. К раствору добавляют избыток трилона Б, индикатор – КХЧС (переход окраски от синего до красно – фиолетового), остаток трилона Б титруют раствором MgCI2.
Дата добавления: 2014-11-06 ; Просмотров: 4194 ; Нарушение авторских прав?
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет





ЛАБОРАТОРНЫЕ ЗАНЯТИЯ
Приготовление бактериологических сред. Приготовить обычные питательные среды. 2. Приготовить специальные и цветные среды. 3. Освоить методы стерилизации сред.
Оборудование и материалы: из расчета на четырех учащихся нужно иметь 150 г мяса говядины, сухой пептон, сухой агар, сухую желатину, свежее снятое молоко, картофелину, поваренную соль, 4%-ный раствор NaOH, технические или аптекарские весы, четыре колбы объемом 250 мл, пробирки, воду, газовые горелки (или примусы, электрические плитки); автоклав, аппарат Коха и печь Пастера.
Бактериологический метод, или метод чистых культур, позволяет определять микроорганизмы по физиологическим свойствам. Для выращивания микробов применяют обычные цветные и специальные питательные среды. На обычных средах растет большинство бактерий. К ним относятся мясопептонный агар (МПА), мясопептонный бульон (МПБ), мясопептонная желатина (МПЖ), молоко и картофель.
Приготовление обычных питательных сред. МПБ. На 500 г изрубленного говяжьего мяса, очищенного от костей, сухожилий, жира и пленок, берут 1 л воды, кипятят 40—60 мин, выжимают через марлю, доливают воду до первоначального объема, прибавляют 1% пептона и 0,5% поваренной соли и кипятят 15 мин. Устанавливают рН среды 7,6—7,8, фильтруют через бумажный фильтр, разливают по пробиркам и стерилизуют в автоклаве при 120 °С в течение 30 мин.
МПА. В готовый МПБ добавляют 3% нарезанного агара, агар расплавляют в текучем паре в аппарате Коха, устанавливают рН 7,6, осветляют яичным белком, фильтруют в аппарате Коха, стерилизуют 30 мин при 120°.
МПЖ. В МПБ нарезают 10% (зимой) или 15% (летом) желатины, расплавляют на водяной бане, доводят рН до 7,6, очищают яичным белком, фильтруют через смоченный бумажный фильтр, разливают по пробиркам и стерилизуют в течение трех дней при 100°С по 30 мин или один раз в автоклаве при 112°С в течение 20 мин.
Молоко. Снятое молоко разбавляют на 2/3 водой, фильтруют, разливают по пробиркам, стерилизуют в аппарате Коха 3 дня по 30 мин.
Картофель чистят, удаляют глазки, режут квадратами, клиньями или ломтиками, держат 20—30 мин в 1%-ном растворе питьевой соды, стерилизуют в аппарате Коха 3 дня по 30 мин.
Приготовление специальных и цветных сред. Специальные среды предназначаются для микроорганизмов, не растущих на обычных средах.
Сывороточные мясопептонный агари бульон. К обычному МПА рН 7,2 добавляют стерильно 10% лошадиной сыворотки. Обычно сыворотку лошади заготавливают один раз в 3—6 мес и хранят ее в темном месте при температуре 2—6 °С. По мере надобности эту сыворотку добавляют к бульону или расплавленному и охлажденному до температуры 45—50 °С мясо-пептонному агару. Например, в каждую пробирку с расплавленным и охлажденным агаром добавляют стерильной пипеткой по 0,5 мл сыворотки. Приготовленные среды проверяют на стерильность.
Картофельный агар. К одной части очищенных картофельных ломтиков добавляют две части водопроводной воды, варят, фильтруют через ватно-марлевый фильтр и к фильтрату, имеющему показатель рН 6,8, добавляют 3% агара. Среду стерилизуют в аппарате Коха 3 дня по 30 мин. Проверяют на стерильность.
Сусловый агар. Неохмеленное (сладкое) пивное сусло, которое получают на пивном заводе, нагревают до 110°С и фильтруют через марлю. Доливают воды до показания ареометра 1,03—1,08, добавляют 3% агара, варят, фильтруют через ватно-марлевый фильтр, разливают по пробиркам и стерилизуют в текучепаровом аппарате Коха 3 дня по 30 мин.
Синтетический агар для энтомофторовых грибов (не растущих на сусловом агаре). Берут бидистиллированной воды 1 л, глюкозы 20 г, аспарагина 3 г, сернокислого магния 0,5 г, фосфорнооднокалиевой соли (КН2РО4) 0,6 г, фосфорнодиухкалиевой соли (К2НРО4) 2,4 г. Устанавливают показатель рН 6,0. В случае надобности добавляют 3% агара. Стерилизуют в аппарате Коха 3 дня по 30 мин.
Мясопептонно-сусловыи агар. Нейтральный МПЛ смешивают пополам с сусловым агаром, разливают по пробиркам и дробно стерилизуют.
Сусловый агар с питательной солью для Ascosphaera apis. Берут агара 2 г, пивного сусла 97,9 г и добавляют 0,1 г питательной соли. [Состав соли: 40% КН2РО4, 40% NH4NO3, 19,9% MgSO4, и 0,1% Fе3(РО4)2].
Цветные среды готовят для определения у изучаемых микробов ферментов на углеводы, что необходимо для определения их вида. Они делятся на жидкие и плотные. Жидкие цветные среды готовят из пептонной воды, индикатора Андредэ и какого-либо одного углевода.
Индикатор Андредэ: 0,5 г кислого фуксина растворяют в 100 мл дистиллированной воды, добавляют 16,4 мл нормального раствора едкого натрия и стерилизуют 5 мин при 110 °С, Индикатор имеет цвет слабо заваренного чая.
Жидкие цветные среды типа Барсикова. К 300 мл дистиллированной воды добавляют пептона 1%, поваренной соли 0,5%, индикатора Андредэ 1%. Разливают в небольшие колбы по 100 мл и в каждую добавляют по 1 г одного из следующих углеводов: глюкозы (Барсиков I), лактозы (Барсиков II), маннита (среда Гетча). По этому типу готовят среды с добавлением одного из следующих углеводов: арабинозы, дульцита, ксилозы, сорбита и др. Дробно стерилизуют. Среды имеют соломенно-желтый цвет без розового оттенка. Хранят в темноте.
Бульон Штерна. В 100 мл бульона (рН 7,6) растворяют 1 мл глицерина, добавляют 5—6 капель фильтрованного насыщенного спиртового раствора основного фуксина и 2 мл свежеприготовленного 10%-ного водного раствора сернистокислого натрия. Разлитую по пробиркам среду стерилизуют дробно или при 110°С 30 мин. Готовый бульон золотистого цвета. При долгом хранении и при действии света среда краснеет, что делает ее непригодной для работы.
Плотные цветные среды. Агар Конради-Дригальского. К 100 мл расплавленного 3%-ного слабощелочного агара (рН 7,6) прибавляют лактозы 1,5 г и после ее растворения добавляют 1 мл водного 0,1%-ного раствора кристаллвиолета и 13 мл лакмусовой настойки. Среду разливают по колбам, дробно стерилизуют при 100 °С 3 дня по 15—20 мин. Хорошо приготовленная среда имеет синий цвет с фиолетовым оттенком.
Агар Эндо. К 100 мл расплавленного МПА (рН 7,6) добавляют лактозы 1 г, спиртового насыщенного основного фуксина (после фильтрования) 0,5 мл и 2,5 мл свежеприготовленного 10%-ного водного раствора сульфита натрия (сернистокислый натрий).
Среду разливают по колбам и дробно стерилизуют. В горячем виде агар слабо-красного цвета, а в холодном — чуть розоватого (цвет человеческой кожи). Иногда сульфита натрия приходится добавлять немного больше, так как препарат бывает в продаже неодинакового качества. Среду хранят в темноте.
Конгорот агар по Либерману и Ацелю. К 100 мл расплавленного МПА (рН 7,6) прибавляют 1,5 г лактозы и 10%-ного водного профильтрованного раствора конгорот 3 мл, стерилизуют дробно. Среда красного цвета. При хранении (длительном) краска выпадает в виде черных взвешенных частичек.
Нейтральрот агар Ротбергера. К 100 мл расплавленного МПА агара (рН 7,6) прибавляют 0,3 г глюкозы и 1 мл насыщенного водного раствора нейтральрота. Среду разливают по пробиркам высоким столбиком и дробно стерилизуют. Цвет среды вишневый.
Получение чистых культур бактерий. Произвести посев бактерий на плотную среду.
Оборудование и материалы: для каждого учащегося готовит по одной пробирке со скошенным МПА, чашку с колониями бактерий, пробирку со стерильным раствором, бактериологическую петлю, спиртовку, предметные стекла, фильтровальную бумагу, микроскоп, кедровое масло, карандаш по стеклу, банку с 2%-ным раствором фенола.
Получение чистой культуры и посев ее на питательные среды. Получение чистой культуры (состоящей из одного вида) бактерий производят методом фракционированного (дробного) посева. Микроорганизмы высевают на среды около горящей спиртовки. В пламени ее фламбируют (стерилизуют) бактериологическую петлю и обжигают края пробирок при их открывании и закрывании пробками. Внесенный петлей в чашку Петри или пробирку с МПА или со специальной средой патологический материал распределяют волнообразной линией легким прикосновением по поверхности среды и ставят в термостат.
Для анаэробных микроорганизмов создают бескислородные условия. Для этого чашки или пробирки ставят в эксикатор с хорошо притертой крышкой или под колокол с притертым дном. Дно колокола смазывают вазелином, чтобы не было подсасывания воздуха. Кислород из этих приборов удаляют или выкачиванием, или замещением индифферентным газом (азотом, водородом), или химическими реакциями. Один из распространенных способов удаления кислорода — поглощение его горением. В эксикатор ставят чашку со спиртом. Спирт поджигают и сразу же закрывают крышку. При горении спирта содержание кислорода значительно снизится и возрастет содержание углекислоты. Однако этот прием не позволяет полностью удалить кислород. Для полного удаления кислорода берут на 1 л объема эксикатора 30 г гидросульфита натрия (Na2S2O4) и 30 г углекислого натрия (Nа2СО3). Эти препараты смешивают и увлажняют водой и сразу же закрывают эксикатор.
Засеянные чашки или пробирки ставят в термостат при температуре 37°С (и при более низкой). На следующий день или через двое суток по ходу посева образуется рост, а в конце линии — отдельные колонии.
Колонии, как правило, вырастают из одной клетки и поэтому составляют начало чистой культуры. Из колонии делают отвивку и сеют эту культуру на обычные или специальные среды.
1. Как питаются микроорганизмы?
2. Как делятся микроорганизмы по типу питания?
3. Дайте характеристику прототрофов, метатрофов и паратрофов.
4. Каковы источники азотистого питания микроорганизмов?
5. Что такое плазмолиз и плазмоптис, в каких условиях происходят эти явления?
6. В чем заключается сущность дыхания?
7. В чем состоит сущность аэробного и анаэробного дыхания?
8. Как делятся ферменты, что такое брожение?
9. Каково назначение питательных сред обычных, специальных, цветных?
10. Как выращиваются анаэробные бактерии?
11. Какие среды относятся к обычным? Назначение каждой из этих сред.
Известно, что скорость биосинтеза жирных кислот во многом определяется скоростью образования триглицеридов и фосфолипидов, так как свободные жирные кислоты присутствуют в тканях и плазме крови в небольших количествах и в норме не накапливаются.
Синтез триглицеридов происходит из глицерина и жирных кислот (главным образом стеариновой, пальмитиновой и олеиновой). Путь биосинтеза триглицеридов в тканях протекает через образование α-глице-рофосфата (глицерол-3-фосфата) как промежуточного соединения.
В почках, а также в стенке кишечника, где активность фермента глицеролкиназы высока, глицерин фосфорилируется за счет АТФ с образованием глицерол-3-фосфата:
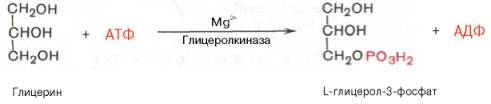
В жировой ткани и мышцах вследствие очень низкой активности глицеролкиназы образование глицерол-3-фосфата в основном связано с процессами гликолиза и гликогенолиза. Известно, что в процессе гли-колитического распада глюкозы образуется дигидроксиацетонфосфат (см. главу 10). Последний в присутствии цитоплазматической глицерол-3-фосфатдегидрогеназы способен превращаться в глицерол-3-фосфат:

Отмечено, что если содержание глюкозы в жировой ткани понижено (например, при голодании), то образуется лишь незначительное количество глицерол-3-фосфата и освободившиеся в ходе липолиза свободные жирные кислоты не могут быть использованы для ресинтеза триглицеридов, поэтому жирные кислоты покидают жировую ткань. Напротив, активация гликолиза в жировой ткани способствует накоплению в ней триглицеридов, а также входящих в их состав жирных кислот. В печени наблюдаются оба пути образования глицерол-3-фосфата.
Образовавшийся тем или иным путем глицерол-3-фосфат последовательно ацилируется двумя молекулами КоА-производного жирной кислоты (т.е. «активными» формами жирной кислоты – ацил-КоА). В результате образуется фосфатидная кислота (фосфатидат):
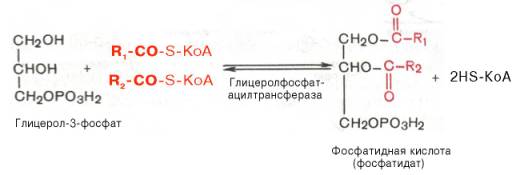
Как отмечалось, ацилирование глицерол-3-фосфата протекает последовательно, т.е. в 2 этапа. Сначала глицерол-3-фосфат-ацилтрансфераза катализирует образование лизофосфатидата (1-ацилглицерол-3-фосфата, а затем 1-ацилглицерол-3-фосфат-ацилтрансфераза катализирует образование фосфатидата (1,2-диацилглицерол-3-фосфата) .
Далее фосфатидная кислота гидролизуется фосфатидат-фосфогидро-лазой до 1,2-диглицерида (1,2-диацилглицерола):
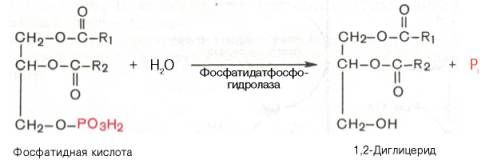
Затем 1,2-диглицерид ацилируется третьей молекулой ацил-КоА и превращается в триглицерид (триацилглицерол). Эта реакция катализируется диацилглицерол-ацилтрансферазой:

Синтез триглицеридов (триацилглицеролов) в тканях происходит с учетом двух путей образования глицерол-3-фосфата и возможности синтеза триглицеридов в стенке тонкой кишки из β-моноглицеридов, поступающих из полости кишечника в больших количествах после расщепления пищевых жиров. На рис. 11.6 представлены глицерофосфатный, дигидроксиацетон-фосфатный и β-моноглицеридный (моноацилглицероловый) пути синтеза триглицеридов.
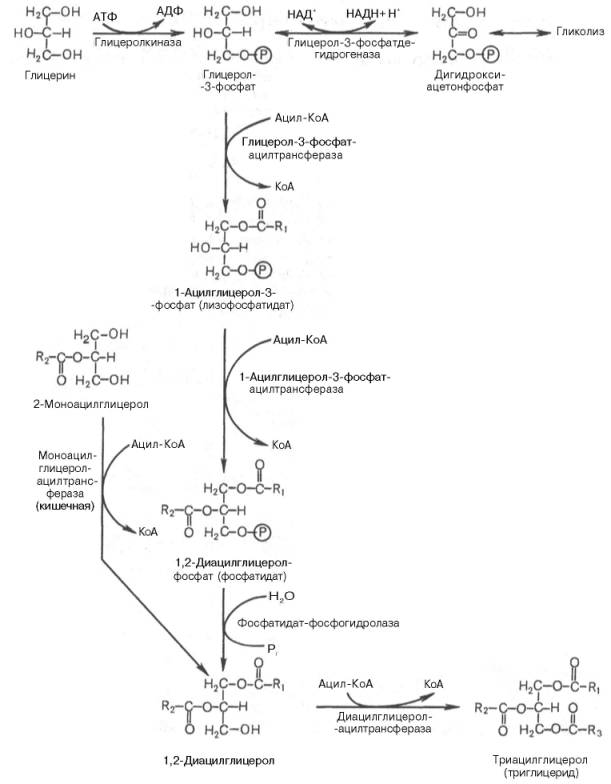
Рис. 11.6. Биосинтез триглицеридов (триацилглицеролов).
Установлено, что большинство ферментов, участвующих в биосинтезе триглицеридов, находятся в эндоплазматическом ретикулуме, и только некоторые, например глицерол-3-фосфат-ацилтрансфераза,– в митохондриях.
Читайте также:







